Webzine Sanità Pubblica Veterinaria
Numero 23 - febbraio 2004 - http://spvet.it
Documento reperibile all'indirizzo:http://spvet.it/indice-spv.html#203


SALMONELLA ABORTUS OVIS: UNA PROBLEMATICA SEMPRE ATTUALE
Nel corso degli ultimi anni abbiamo avuto modo di osservare un aumento del numero di focolai di aborto ovino causato da Salmonella Abortus ovis.
Essa è considerata uno dei principali agenti abortigeni nella pecora: può quindi essere interessante riepilogare le informazioni recenti relative a quest'infezione, che pur essendo conosciuta da tempo, provoca ingenti danni economici all'allevatore. Tali danni sono sia di tipo sia diretto che indiretto e possono essere così riepilogati:
- perdita di agnelli e talvolta delle madri;
- costi legati all'improduttività per il mancato ritorno in calore dell'animale o per la necessità di indurre farmacologicamente l'estro;
- riduzione o assenza della produzione lattea;
- deprezzamento del gregge;
- perdite "genetiche" tra le femmine miglioratrici, a causa di metriti e ritenzioni placentari che possono portare ad infertilità. (Pardon P. et al., 1988)
Una recente indagine, effettuata in Sardegna, ha rilevato la presenza di questo batterio nel 10% di campioni provenienti da aborti (Tola S., 2002).
Nel nostro Istituto i dati provenienti dalla attività diagnostica confermano l'importanza di S. Abortus ovis quale agente abortigeno nella pecora, isolato a partire da feti abortiti ed annessi fetali, in diversi casi dal 1997 ad oggi. Questa review nasce quindi dalla esigenza di approfondire le conoscenze sull'infezione sostenuta dalla Salmonella Abortus ovis.
EZIOLOGIA.
S. a. si distingue per alcune caratteristiche colturali, tanto da poter essere considerata una Salmonella "atipica" per la sua crescita lenta e per la tardività delle sue reazioni biochimiche, cosa che rende ragione delle difficoltà riscontrabili poi in sede diagnostica.
Appartiene alla famiglia Enterobacteriaceae, specie Salmonella enterica (che comprende sette subspecie distinte sulla base di criteri biochimici e genomici, con oltre 2000 sierotipi identificati in base agli antigeni O ed H, rispettivamente somatico e flagellare), subspecie enterica: si tratta di uno dei sierotipi strettamente ospite-associato, elemento che ne giustifica le peculiari caratteristiche epidemiologiche.
Ha diffusione cosmopolita, con prevalenza in Europa (è la principale causa di aborto ovino in Francia) e Medio Oriente. (Pardon P. et al, 1990).
Sono germi Gram negativi bastoncellari (2-4 x 0,5-1µm), mobili, acapsulati, anaerobi facoltativi, catalasi positivi ed ossidasi negativi. Al microscopio elettronico presentano una "seconda membrana esterna", di probabile natura polisaccaridica, non presente nelle altre salmonelle, ma il cui ruolo patogenetico non è stato ancora delucidato. (Gonzalez L., 2002; Le Minor et Popoff,1987).
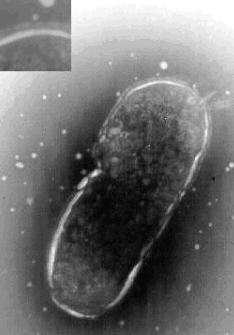
Foto 1A: S. Abortus ovis. Nell'inserto il particolare della "doppia membrana" (Bar 5 µm).
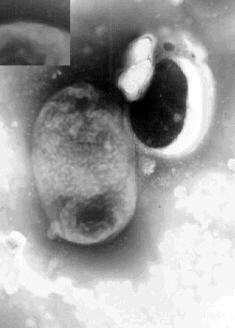
Foto 1B: S. Tiphymurium. Nell'inserto il particolare della membrana.
A differenza dei membri dello stesso genere, S. Abortus ovis cresce lentamente sui terreni di coltura: sono necessarie da un minimo di 24 h fino a 36-48 h, talvolta 72 h, alla temperatura di 35-37° C, per sviluppare su agar Salmonella-Shigella, che viene considerato il terreno più adatto. Cresce lentamente anche sui terreni convenzionali quali l'agar Citrato Desossicolato, il Rambach ed il Mac Conkey, dove produce colonie non fermentanti il lattosio.
Le colonie, in oltre, sono più piccole rispetto alle altre specie di Salmonella, e spesso di dimensioni variabili (coesistono contemporaneamente sullo stesso terreno colonie di dimensioni diverse)(Carter et al., 1999; Ruffo, 1998).

Foto 2: aspetto delle colonie di S. Abortus ovis: notare le dimensioni variabili del germe su Rambach Agar
Sul terreno TSI presenta un profilo acido-basico, con produzione di idrogeno solforato e di gas.

Foto 3: becco di Triple Sugar Iron (TSI) inoculato con S. Abotus ovis.
: profilo alcalino/ acido/ H2S positivo/gas positivo
Altre caratteristiche metaboliche importanti per l'identificazione sono indicate nella Tabella 1.
|
Tabella 1: Caratteristiche metaboliche di Salmonella Abortus ovis. |
|
Produzione di acido da: Lattosio | - |
| Saccarosio | - |
| Glucosio | + |
| Maltosio | + |
| Sorbitolo | + |
| Mannitolo | + |
| Dulcitolo | Variabile |
| Produzione di: Indolo | -
|
| Ureasi | - |
| H2S (1) | + |
| gas in TSI | + |
| Inattivata da: pH | <4 e >9 |
| temperatura | <10° C e >42° C |
(1) La produzione di H2S è ben visibile su TSI, ma meno sui comuni terreni come il Salmonella-Shigella o l'XLT4 dove a differenza delle altre salmonelle, le colonie presentano un centro scarsamente colorato di nero.
S. Abortus ovis sopravvive nell'ambiente esterno, resistendo circa 100 giorni nell'acqua piovana, 50-90 gg nella lettiera, alcuni mesi nel terreno (forme rugose del germe).
Nei prodotti di origine animale la sua resistenza non è stata studiata, d'altra parte non sono segnalati casi di infezione nell'uomo. (Pardon P. et al., 1988).
SEGNI CLINICI
Clinicamente il sintomo principale è rappresentato dall'aborto (spesso interessa anche il 60% delle femmine di un gregge), che si verifica nella seconda metà o nell'ultimo terzo di gravidanza, sebbene non si possa escludere che esso avvenga più precocemente.
L'aborto si verifica poche settimane dopo il contagio e non è preceduto da sintomi rilevanti, ad eccezione di una ipertermia transitoria (in corrispondenza della breve batteriemia) che spesso passa inosservata.
In alcuni casi l'aborto può essere seguito da ritenzione di placenta e/o metrite (nel determinismo della quale rientrano per lo più germi di irruzione secondaria) con conseguente setticemia talvolta mortale per la pecora. Possono verificarsi anche nati-mortalità o nascita di agnelli a termine ma disvitali, che vengono a morte nel giro di poche ore per setticemia.
E' possibile la nascita di agnelli apparentemente sani che però entro 2-3 settimane muoiono in presenza o meno di sintomi respiratori od enterici.
Tale evenienza sembra legata alla infezione del feto a fine gravidanza (oltre la sedicesima settimana di gestazione) o immediatamente dopo la nascita (Blood D.C. et al.,1993; Timoney J.F. et al., 1999).
Forme polmonari sono state osservate in agnelli di 1-3 mesi di età. Infine sembra che gli agnelli che si sono infettati in periodo pre-natale o peri-natale possano restare portatori sani sino alla pubertà (Pardon P. et al., 1988).
RILIEVI ANATOMO-PATOLOGICI
All'esame anatomo-patologico non si rilevano lesioni patognomoniche. Il feto e la placenta possono mostrare segni di setticemia e di autolisi. (foto 4).
Foto 4: Feto abortito di pecora.
Nei nati morti e negli agnelli morti subito dopo la nascita si osservano edema, emorragie, degenerazione e necrosi in numerosi organi, ma anche nei cotiledoni e nel corion-allantoide.
E' possibile osservare mineralizzazione di singole cellule trofoblastiche o di aree dell'allantoide, nonché presenza di neutrofili e batteri nei villi placentari.
Nelle pecore spesso si ha ritenzione di placenta con metrite, da cui l'utero risulta ingrossato e ripieno di materiale necrotico ed essudato. Giovani agnelli e pecore con diarrea possono presentare abomasite ed enterite associati ad aumento di volume dei linfonodi regionali (Gonzalez, 2002).
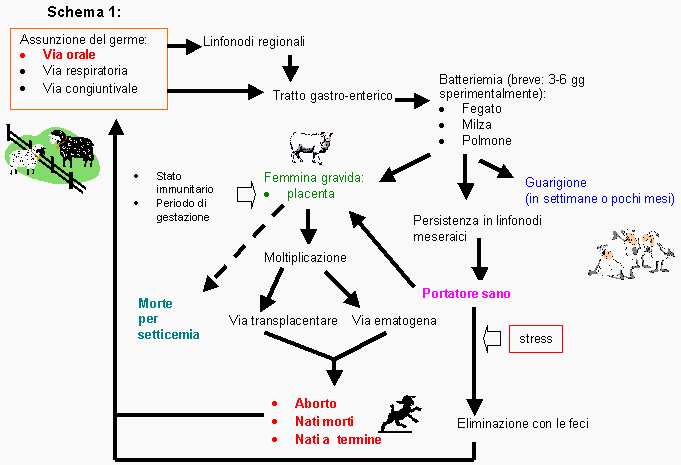
EPIDEMIOLOGIA E PATOGENESI
Salmonella abortus-ovis è strettamente ospite- adattata (rarissimi casi sono stati trovati nei caprini e nei conigli che sembrano corrispondere a vicoli ciechi epidemiologici), dunque il suo ingresso in un gregge indenne si deve ricondurre alla introduzione di un soggetto infetto che spesso è un portatore asintomatico (Gonzalez L., 2002; Ruffo G., 1998; Pardon P. et al.,1988).
La trasmissione indiretta attraverso veicoli, materiali ed alimenti contaminati è possibile ma non dimostrata.
La trasmissione per via diretta, le cui modalità non sono comunque chiare, vede come principali fonti di contagio il feto abortito, la placenta e le secrezioni uterine della pecora infetta, rappresentando l'unità feto placentare, il principale sito di replicazione di questo germe (l'escrezione di S. Abortus ovis si ha soprattutto durante la prima settimana dopo l'aborto, ma prosegue fino ad un mese dopo!).
La possibilità di trasmissione è infatti massimale nel periodo dei parti.
Il germe può essere escreto anche con le feci, evenienza rara che si verifica in caso di ritenzione di placenta e setticemia. L'isolamento di Salmonella Abortus ovis dai polmoni di agnelli in greggi infetti può essere indice di una sua possibile eliminazione attraverso la via respiratoria (Fernandez-Diez et al., 1977).
Inoltre sembra che l'agnello possa infettarsi anche tramite l'assunzione di colostro e latte infetto o a causa della contaminazione esterna della mammella, o durante il parto.
Un ruolo epidemiologico di scarsa importanza è invece svolto dal montone, che pur se costantemente asintomatico, produce un eiaculato infetto che, al momento dell'accoppiamento, consente la colonizzazione della vagina della femmina da parte del germe, senza che esso però sia in grado di raggiungere l'utero (Sanchis R., Pardon P., 1986).
L'infezione avviene principalmente attraverso la via orale, ma anche respiratoria e congiuntivale.
I batteri, quindi, colonizzano i linfonodi regionali o passano direttamente nel tratto gastrointestinale.
Dopo una breve batteriemia, durante la quale organi come fegato, milza e polmoni vengono temporaneamente colonizzati, i germi vengono eliminati dall'ospite, portando a completa guarigione, oppure persistono nei linfonodi o nell'intestino, portando allo stato di "portatore asintomatico".
Tuttavia nelle pecore gravide, i germi raggiungono l'unità feto-placentare e qui replicano più o meno attivamente in base al periodo della gestazione e dello stato immunitario della pecora.
L'immunosoppressione locale che interessa l'utero durante la gravidanza e che favorisce l'impianto embrionale, rende la placenta un sito di moltiplicazione batterica ideale consentendo la colonizzazione anche da parte di una bassa carica infettante.
Le salmonelle raggiungono il feto per via ematica e transplacentare provocando aborto, morte fetale o nascita di agnelli a termine. (vedi schema 1).
Numerosi fattori stressanti possono agire su un soggetto portatore favorendo la moltiplicazione batterica e dunque la escrezione con le feci del germe.
In tal senso agiscono il digiuno, infestioni parassitarie del fegato e del tratto gastro-enterico e trattamenti antibiotici che hanno alterato la flora intestinale dell'animale.
L'individuazione di un soggetto portatore di S. Abortus ovis, non è semplice: l'isolamento del germe dal cieco, retto, abomaso e linfonodi che drenano il tratto intestinale, ha spesso esiti negativi a differenza di quanto avviene per le altre salmonellosi, tanto da far dubitare alcuni autori della effettiva esistenza dei portatori stessi (Samuel et al., 1981). E' dunque necessario ricorrere ad indagini sierologiche.
La pecora può morire per setticemia e nella fase ante-mortem la temperatura corporea subisce un decremento raggiungendo 35-37° C, favorendo la moltiplicazione di S. Abortus ovis.
La lisi delle numerosissime salmonelle, in fase preagonica, determina il rilascio di un lipopolisaccaride (LPS) che agendo sulla mucosa intestinale sia direttamente che indirettamente (tramite interazione con mediatori liberati da cellule del sistema immunitario), provoca diarrea che contribuisce alla disseminazione del germe nell'ambiente (Stephen et al., 1985; Pardon P. et al.).
Quando S. Abortus ovis è introdotta per la prima volta in un gregge indenne, l'aborto assume carattere epidemico; negli anni successivi l'infezione diventa endemica con aborti sporadici che si verificano più spesso nei soggetti giovani o appena introdotti nel gregge.
All'infezione naturale segue infatti un solido stato immunitario protettivo nel corso delle gestazioni successive (Ruffo G., 1998).
DIAGNOSI
L'isolamento della S. Abortus ovis si esegue a partire da fegato, cervello e contenuto gastro-intestinale del feto; dalla placenta e dal secreto vaginale delle pecore che hanno abortito. In quest'ultimo caso i tamponi vaginali vanno prelevati entro una settimana dall'aborto.
Purtroppo i sistemi di identificazione convenzionali per le Enterobacteriaceae, quale l'API20E, non riescono ad identificare S. Abortus ovis.
Tale fattore unito alla lenta crescita ed ai lunghi tempi di utilizzo dei substrati biochimici, può ostacolare l'identificazione di S. Abortus ovis e ritardare di conseguenza i possibili provvedimenti da attuare sul resto del gregge per arginare l'infezione.
Il metodo più comune di diagnosi sierologica è rappresentato dal Test di Sieroagglutinazione lenta (SAL), il cui antigene è costituito da una sospensione di antigene somatico O, o flagellare H.
Già due-tre mesi dopo l'aborto, però, i titoli anticorpali diminuiscono drasticamente sebbene si possano individuare ancora soggetti portatori asintomatici sierologicamente positivi, ma negativi all'esame batteriologico (Pardon P. et al., 1986).
Altri test sierologici presenti in bibliografia sono: Inibizione della Emoagglutinazione, Fissazione del Complemento, Immunofluorescenza Indiretta, Opsonizzazione, Gel Immuno Diffusione, ELISA (più sensibile della SAL, è da preferirne l'uso qualora ci si trovi di fronte a più sierovarianti), Coagglutinazione ed un Test Allergico Cutaneo tramite inoculazione intradermica alla plica caudale (in grado di identificare le positività per un periodo dopo l'aborto più lungo rispetto alla SAL).
Tali test non presentano però particolari vantaggi rispetto alla SAL che per semplicità di esecuzione, costi contenuti e risultati soddisfacenti, resta la metodica elettiva.
Negli animali la titolazione degli anticorpi, benché non identificativa ai fini di una diagnosi individuale, può assumere un certo significato nel riconoscimento degli allevamenti infetti, quindi come strumento diagnostico di gruppo (Erganis O. et al., 2002).
Tuttavia l'impossibilità di distinguere gli anticorpi derivanti da una infezione naturale da quelli dovuti ad una profilassi vaccinale (estesamente attuata, soprattutto nelle zone endemiche), rende difficile l'interpretazione dei risultati, soprattutto quando i titoli anticorpali sono di valore medio-basso.
In tal caso si può ovviare in parte a tale problema attuando un secondo prelievo a distanza di circa 15 giorni dal primo per valutare così una eventuale sieroconversione.
DIAGNOSI DIFFERENZIALE
Vanno prese in considerazione: Brucellosi (soprattutto B. melitensis), Listeriosi, Febbre Q, Clamidiosi (principalmente C. psittaci var. ovis), Campilobacteriosi, Toxoplasmosi e le altre Salmonellosi.
PROFILASSI E TERAPIA
Profilassi diretta: isolamento dei soggetti che hanno abortito, distruzione dei prodotti dell'aborto e disinfezione degli ambienti associata alla distruzione della lettiera infetta.
Una disinfezione completa comporta tre tempi:
- pulizia: dopo aver allontanato gli animali, rimuovere la lettiera e pulire a fondo pavimenti, pareti ed oggetti inamovibili, con getti d'acqua ad alta pressione e o detergenti;
- vuoto sanitario per almeno 10 giorni;
- disinfezione tramite disinfettanti appropriati. (Benazzi P., 2002).
Nella realtà dell'allevamento ovino, tuttavia, il vuoto sanitario è di difficile applicazione dal momento che il ciclo produttivo non prevede il "tutto vuoto-tutto pieno".
Nelle zone indenni è opportuno, infine, introdurre solo nuovi soggetti sierologicamente negativi a S. Abortus ovis.
Profilassi indiretta: uso di vaccini, soprattutto nelle zone endemiche. I vaccini inattivati (con fenolo, formolo, calore o per associazione di questi ultimi due) sono facili da produrre ma scarsamente immunogeni (richiedono diverse somministrazioni parenterali durante la stessa stagione). I vaccini vivi (attenuati o meno), non disponibili nel nostro Paese, danno una immunità migliore di quelli inattivati.
I vaccini attenuati (ottenuti da ceppi mutanti di S.Abortus ovis, Rv6-streptomycin-indipendent reverse mutant -, e di S. Typhimurium) possono essere somministrati sia prima della monta che durante la gestazione, ed in studi effettuati in laboratorio su topi, risultano stabili e sufficentemente immunogeni (Lantier F. et al., 1983).
I vaccini vivi non attenuati vanno somministrati per via orale 2-3 mesi prima della monta ma possono talvolta provocare la morte dei soggetti vaccinati (Gonzalez L., 2002).
Attualmente in Italia sono in commercio solo vaccini inattivati da somministrare per via sottocutanea allo scopo di stimolare una risposta immunitaria cellulo-mediata, più protettiva per questo genere di infezione. I vaccini, alcuni dei quali sono vaccini stabulogeni, vengono prodotti da alcuni Istituti Zooprofilattici e da alcune ditte private (SIVAR, 2002).
L'Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche produce tale vaccino dietro accertamento diagnostico della malattia in un allevamento o in una zona ritenuta a rischio epidemiologico come nel caso di greggi limitrofe a focolai di Salmonella Abortus ovis.
Le caratteristiche del vaccino prodotto sono riportate nel foglietto illustrativo ad esso allegato e qui riportato in copia.
Il vaccino viene allestito dietro richiesta medico veterinaria, eseguita in semplice copia, con l'indicazione del quantitativo e dell'allevamento a cui è destinato.
L'intervento immunizzante prevede l'inoculazione di 2 ml di vaccino per via sottocutanea nella regione del collo, da ripetersi a distanza di 12-15 giorni ed un richiamo effettuato in periodi diversi in base alla tipologia di allevamento.
Infatti nel caso di allevamenti con parti programmati, la vaccinazione viene effettuata con un primo intervento alcuni giorni prima dell'accoppiamento, da ripetersi dopo 12-15 giorni ed un richiamo a metà gravidanza.
Negli allevamenti con "parti continuati" invece, la vaccinazione non potrà prevedere un programma di intervento mirato allo stato fisiologico degli animali, e quindi la vaccinazione consisterà in un primo intervento da ripetere dopo 12-15 gg e successivi richiami semestrali.
Benché del tutto sicuro dal rischio di diffusione ambientale o di riacquisizione di virulenza del germe eventualmente attenuato, come nei vaccini vivi, il vaccino spento non è del tutto scevro da rischi per la salute dell'animale.
Infatti l'adiuvante utilizzato (idrossido di alluminio) può portare alla formazione di granulomi nel sito di inoculo, oppure una pratica igienicamente inadeguata della vaccinazione può portare ad infezioni secondarie (Marcato P.S., 1997).
L'evento più grave da scongiurare è però una risposta allergica al vaccino sino ad arrivare allo shock anafilattico, evenienza possibile qualora l'animale sia in precedenza entrato in contatto col germe (a tal proposito è bene tenere presente che spesso la vaccinazione viene attuata dopo l'ingresso del germe nel gregge, a seguito dell'isolamento di S. Abortus ovis in feti abortiti!).
Tuttavia la rarità di tali episodi, rende la vaccinazione una scelta opportuna nelle zone endemiche.
Di solo interesse storico è l'infezione naturale "controllata" ottenuta mettendo a contatto soggetti sani con pecore che hanno abortito. Gli inconvenienti ed i rischi di tale metodica sono evidenti, tanto che attualmente essa non è più praticata.
Il trattamento antibiotico, condotto con antimicrobici ad ampio spettro, può essere utile nel prevenire la metrite e la setticemia nelle pecore che hanno abortito. Ad esempio ossitetraciclina per via parenterale si è dimostrata in grado di prevenire gli aborti nel gregge allo scoppiare di un focolaio.
Tuttavia la necessità di impiegare prodotti long-acting o di somministrare questi farmaci per più di 7-10 gg comporta costi molto elevati, motivo per il quale si esclude il trattamento antibiotico quale presidio profilattico per questa infezione. (Pardon et al., 1988).
In vitro S. Abortus ovis risulta resistente ad eritromicina, novobiocina, penicillina, sulfonamide, ed alcuni ceppi anche alla streptomicina (Gonzalez L., 2002).
I dati presenti nel nostro Istituto, relativi agli isolamenti dal 1997 al 2003, raccolti nell'ambito del sistema di sorveglianza per gli enteropatogeni (sistema Enternet) tramite test Kirby-Bauer, consentono di trarre alcune informazioni relative alla sensibilità verso alcuni composti. Innanzitutto, gli antibiotici per i quali è possibile rintracciare informazioni per tutto il lasso di tempo considerato sono acido nalidixico, ampicillina, cloramfenicolo, gentamicina, ciprofloxacina, tetraciclina, streptomicina.
I dati sono riassunti nel grafico.
E' possibile notare come la sensibilità di S. Abortus ovis sia buona per la maggior parte di questi chemioterapici. Eccezione è costituita dalla streptomicina, per la quale solo il 55,1 % risulta sensibile, dato che S. Abortus ovis condivide con altri germi appartenenti al genere Salmonella., come d'altra parte quello relativo alla gentamicina (89.6%).
Tabella 2: Salmonella Abortus Ovis isolate nell'IZS dell'Umbria e delle Marche dal 1997 al 2003:
esito degli antibiogrammi espresso in percentuale dei ceppi testati sul risultato. |
| Sigla antibiotici | Antibiotici | Sensibile | Resistente | Intermedio |
| AMC | Amoxicillina+Ac. Clavulanico | 100 | 0 | 0 |
| AMP | Ampicillina | 89,65 | 10,3 | 0 |
| AN | Aminosidina | 100 | 0 | 0 |
| CAN | Canamicina | 100 | 0 | 0 |
| CAZ | Cefpazidime | 100 | 0 | 0 |
| CF | Cefalotina | 100 | 0 | 0 |
| CIP | Ciprofloxacina | 100 | 0 | 0 |
| CL | Colistina | 100 | 0 | 0 |
| CLO | Cloranfenicolo | 100 | 0 | 0 |
| CRO | Ceftriaxone | 100 | 0 | 0 |
| CTX | Cefotaxime | 100 | 0 | 0 |
| CXM | Cemotaxime | 100 | 0 | 0 |
| ENR | Enrofloxacin | 100 | 0 | 0 |
| FT | Furanes | 100 | 0 | 0 |
| GEN | Gentamicina | 89,65 | 10,3 | 0 |
| N | Neomicina | 100 | 0 | 0 |
| NA | Acido Nalidixico | 96,5 | 0 | 3,4 |
| PIP | Piperacillina | 95,2 | 4,76 | 0 |
| S | Streptomicina | 55,1 | 24,1 | 20,7 |
| SUL | Sulfonamide | 100 | 0 | 0 |
| SXT | Sulfametossazolo | 23,8 | 76,2 | 0 |
| TET | Tetraciclina | 96,5 | 0 | 3,4 |
| TM | Tobramicina | 66,6 | 0 | 33,3 |
| TRI | Trimethoprim | 100 | 0 | 0 |
Grafico 1: SALMONELLA ABORTUS OVIS: percentuali di ceppi esaminati per tipo di antibiotico

Grafico 2: percentuali di sensibilità dei ceppi vs. acido nalidixico, ampicillina, cloramfenicolo, gentamicina, ciprofloxacina, tetraciclina;, streptomicina, cefotaxime.
In specifico le Salmonellosi sono trattate negli Articoli 122 e 123 del suddetto D.P.R. In particolare l'Art. 122 detta:
"Nei casi di salmonellosi degli animali il sindaco adotta, in tutto o in parte, i provvedimenti seguenti...(omissis):
- isolamento e sequestro degli animali infetti;
- accurate disinfezioni delle stalle e particolarmente nelle poste occupate dagli animali infetti, distruzione dei feti e degli invogli fetali ed idoneo trattamento delle deiezioni;
- rigorose norme igieniche per l'alimentazione, il governo e la mungitura degli animali;
- divieto di monta degli animali infetti;
- divieto di consumo del latte prodotto dagli animali infetti se non previamente risanato.
Il sequestro è tolto, di norma, dopo la guarigione dell'animale ammalato, ma può essere mantenuto sino alla macellazione nel caso che l'animale risulti eliminatore di salmonelle patogene per l'uomo. Il Sindaco deve segnalare tempestivamente al direttore del macello di destinazione l'inoltro degli animali infetti". (D.P.R. 320/1954).
Tali disposizioni sono più rigide, soprattutto in materia di prodotti di origine animale destinati all'alimentazione umana, qualora si tratti di salmonellosi fonti di zoonosi per l'uomo, di cui S. Abortus ovis non fa parte, trattandosi, come in precedenza più volte detto, di una sierovariante strettamente ospite-adattata.
Al contrario per S. Abortus ovis risulta molto importante l'applicazione delle misure di profilassi diretta indicate nei punti 1 e 2.
RINGRAZIAMENTI
Dr.ssa E. Manuali ( Microscopia Elettronica e Istopatologia) i sigg. M. Sabatini e A. Caporali per il supporto tecnico fornito; la Dr.ssa Cagiola per la parte relativa ai vaccini, la Dr.ssa Scuota per i dati relativi alla rete ENTERNET, la Dr.ssa Piera Mazzone e il Dr. Giovanni Filippini per il materiale iconografico, la Dr.ssa Mariangela De Curtis per l'elaborazione dei dati, infine il Dr. Battistacci per i suggerimenti forniti nell'ambito della diagnosi sierologica.
BIBLIOGRAFIA
1. Benazzi P.:Programma di una disinfezione. Il regolamento di Polizia Veterinaria, 2002; 8, 626-630.
2. Blood D.C., Radostits O.M., Henderson J.A.: Veterinary medicine: Patologia medica veterinaria dei bovini, ovini, suini, caprini ed equini. Sesta edizione italiana, 1993; 18, 730-731.
3. D.P.R. 320/1954: Regolamento di Polizia Veterinaria, annotato, integrato ed aggiornato al 31 Agosto 2002;Benazzi P.; 24, 936-940.
4. Erganis O., Kaya O., Hadimili H.M., Guler L.: Rapid diagnosis of ovine Brucella, Campylobacter and Salmonella infections from fetal stomach contents by coagglutination test. Small Ruminant Research, 2002; 45, 123-127.
5. Fernandez-Diez M., Rojo-Vazquez J., Aller-Gancedo J.M.: Incidencia de la infecciòn por Salmonella abortus ovis en elganado ovino y caprino de la region del Duero; sensibilidad in vitro. Suplemento Cientifico-Tecnico del Boletin Informativo del Consejo General de Colegios Veterinarios de Espana, 1986; 207-8, 102-7.
6. Gonzalez L.: Salmonella abortus ovis infection. In "Diseases of sheep" di Martin, 2002; 15, 102-106.
7. Lantier F., Pardon P., Marly J.:Immunogenicity of a Low-Virulence vaccinal strain against Salmonella abortus ovis infection in mice. Infect. Immun., 1983; Vol. 40, No. 2, 601-607.
8. LeMinor L., Popoff My.: Designation of Salmonella enterica Sp Nov, as the type and only species of the genus Salmonella. Request for an opinion. Int. J. Sist. Bacteriol., 1987; 37, 465-468.
9. Marcato P.S.: Infiammazioni granulomatose. Anatomia ed istologia patologica veterinaria, 1997; 17, 340-353.
10. Pardon P., Popoff M.Y., Coynault C., Marly J., Miras I.: Virulence-associated plasmids of Salmonella Serotype typhimurium in experimental murine infection. Ann. Microbiol., 1986; 137B, 47-60.
11. Pardon P., Sanchis R., Marly G., Lantier F., Guilloteau L., Buzoni-Gatel D., Oswald I.P., Pépin M., Kaeffer B., Berthon P., Popoff M.Y.: Experimental ovine salmonellosis (Salmonella abortus ovis): pathogenesis and vaccination. Res. Microbiol., 1990; 141, 945-953.
12. Pardon P., Sanchis R., Marly J., Lantier F., Pépin M., Popoff M.: Salmonellose ovine due a Salmonella abortusovis. Ann. Rech. Vét., 1988; 19, 221-235.
13. Quinn P.J., Carter M.E., Markey B., Carter G.R.: Enterobacteriacae. In "Clinical Veterinary microbiology", 1999; section 2, 18, 284-336.
14. Ruffo G.: Salmonella. In "Malattie infettive degli animali" di R. Farina e F. Scatozza, 1998; 7, 123-132.
15. Samuel J.L., Eccles J.A., Francis J.: Salmonella in the intestinal tract and associated lymph nodes of sheep and cattle. J. Hyg, 1981: 87, 225-232.
16. Sanchis R., Pardon P.: Infection experimentale du belier par Salmonella abortus ovis. Annales de Recherches Veterinaires, 1986; 17, 387-93.
17. SIVAR: Prodotti immunizzanti ovi-caprini. Prontuario terapeutico veterinario Sivar, 2002.
18. Stephen J., Wallis T.S., Starkey W.G., Candy D.C.A., Osborne M.P.: Salmonellosis: in retrospect and prospect. In Microbial toxins and diarrheal disease, 1985; 175-178 Pitman London.
19. Timoney J.F., Gillespie J.M., Scott F.W., Barlough J.E.: Microbiologia e malattie infettive degli animali domestici, 1999; 8, 93-106.
20. Tola S., Porcu R., Maccioccu S., Chessa G., Casu L.M., Sale S., Masala G.: Aborti ovini e caprini in Sardegna: analisi riferita a Salmonella abortus ovis, Toxoplasma gondii e Coxiella burnetii. In: Atti del XV Congresso Nazionale S.I.P.A.O.C, Grand Hotel Chia Laguna-Cagliari, 11-14 Settembre 2002; pag. 15.