Biblioteca Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Sanità Pubblica Veterinaria: Numero 79, Agosto 2013 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#578
Valutazione della sensibilità alla Pirazinamide degli isolati di Mycobacterium caprae circolanti in Italia - Evaluation of Pyrazinamide Susceptibility of Mycobacterium caprae isolates circulating in Italy
Corneli S., Pacciarini M. L., Boniotti M. B., Zanoni M. G., Piersimoni C., Biagetti M., Di Paolo A., Curina G., Mazzone P.
Abstract. Mycobacterium caprae together with Mycobacterium bovis is the etiological agent of bovine tuberculosis. The main feature that differentiates M. caprae from M. bovis is the sensitivity to pyrazinamide (PZA), a first-line anti-tuberculosis drug in human medicine. This work focused on phenotypic and genotypic characteristics responsible for M. caprae sensitivity to PZA. PZA susceptibility testing of Italian M. caprae isolates was performed on liquid specific media with the radiometric technique (BACTEC 460 system) then replaced by the new non-radiometric method (BACTEC MIGIT 960). On selected isolates was carried out an analysis of the gyrB gene and sequencing of the gene pncA to deepen genotypic characteristics responsible for sensitivity of M. caprae to PZA. Moreover some M. caprae, characterized by spoligotypes mainly widespread in Italy, were selected and evaluated for susceptibility to other antibiotics normally used in the tuberculosis therapy in human medicine
Riassunto. Mycobacterium caprae, insieme a Mycobacterium bovis, rappresenta l'agente eziologico responsabile della tubercolosi bovina; la caratteristica principale che differenzia M. caprae da M. bovis è la sensibilità alla pirazinamide (PZA), farmaco antitubercolare di prima scelta in medicina umana. Questo lavoro si è concentrato sulle caratteristiche fenotipiche e genotipiche alla base della sensibilità di M.caprae alla PZA. La sensibilità alla PZA sugli isolati Italiani di M. caprae è stata valutata su terreni liquidi specifici con la tecnica radiometrica (BACTEC 460 system) poi sostituita dal metodo non radiometrico (BACTEC MIGIT 960). Sugli isolati è stata effettuata l'analisi del gene gyrB e il sequenziamento del gene pncA per approfondire le caratteristiche genotipiche responsabili della sensibilità di M.caprae alla PZA. Inoltre per alcuni ceppi di M. caprae, selezionati tra gli spoligotipi più diffusi in Italia, è stata valutata la suscettibilità ad altri principi attivi normalmente utilizzati nella terapia antitubercolare in medicina umana
Introduzione
Il Mycobacterium caprae, appartenente al Mycobacterium tuberculosis complex (MtbC) (Figura 1) è considerato, insieme con il Mycobacterium bovis, l'agente eziologico della tubercolosi bovina (bTB) negli animali domestici e selvatici, ed entrambi sono responsabili di forme cliniche di tubercolosi nell'uomo indistinguibili dalle forme sostenute da M. tuberculosis (Kubica et al., 2003).
Nel progetto ci si è concentrati sulla valutazione fenotipica e genotipica della sensibilità dei ceppi di M. caprae alla pirazinamide (PZA), farmaco antitubercolare di prima scelta in medicina umana. La sensibilità alla PZA rappresenta la principale caratteristica biochimica che differenzia M. caprae da M. bovis e che allo stesso tempo accomuna M. caprae e M. tuberculosis.
Le caratteristiche fenotipiche e genotipiche che differenziano il type strain di M. caprae gM-1T (CIP 105776T=ATCC BAA-824T) da M. bovis sono: una debole positività al test dell'idrolisi del Tween 80 dopo 10 giorni, che non si osserva in M. bovis, la sensibilità alla PZA, che non inibisce la crescita di M. bovis, e una particolare combinazione di polimorfismi genetici (Tabella 1).
La PZA è definita un profarmaco, per esplicare la sua azione deve essere trasformata dalla pirazinamidasi in acido pirazinoico che ne costituisce il principio attivo.
La maggior parte dei ceppi resistenti alla PZA mancano dell'enzima pirazinamidasi, codificato dal gene pncA, quindi non possono trasformare la PZA nel suo principio attivo. Oltre l'80% dei ceppi PZA-resistenti presentano mutazioni nel gene pncA. Le prove di sequenziamento negli isolati di M. caprae analizzati nello studio hanno evidenziato la presenza del gene pncA "wild-type" diversamente da M. bovis (Aranaz et al., 2003).
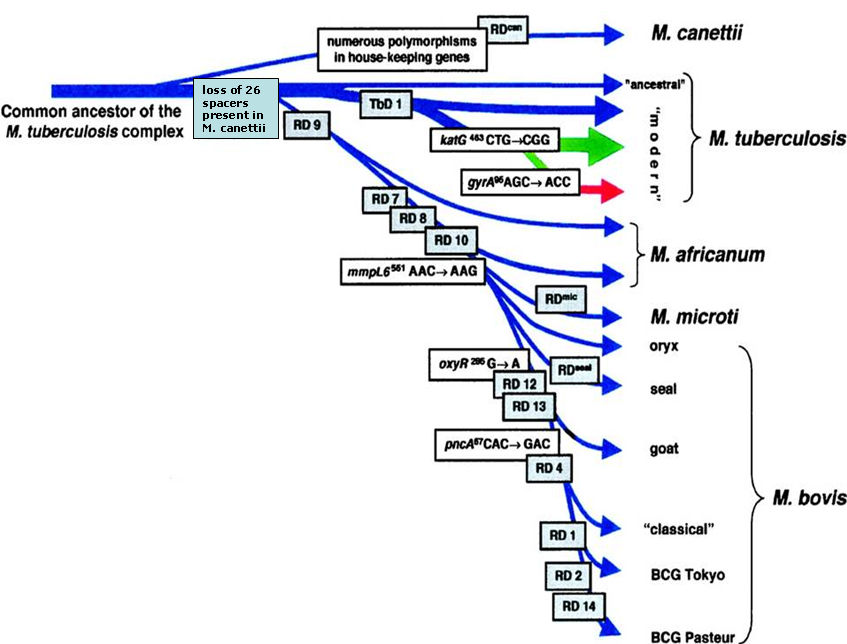
Figura 1 - Filogenesi MtbC da Brosch R. et al, 2002, modificato
Materiali e Metodi
Isolati di M. caprae: Trentadue ceppi di M. caprae, di cui 22 più diffusi e 10 rari, rappresentativi dei ceppi isolati in Italia tra il 2000 e il 2010, sono stati selezionati dalla banca dati del Centro di Referenza Nazionale per la Tubercolosi bovina (CdRNTb) sulla base del genotipo (combinazione spoligotipo/profilo ETR e VNTR), della posizione geografica e della specie animale di provenienza (Figura 2).
In particolare, tra gli isolati più diffusi, sono stati scelti ceppi caratterizzati dagli spoligotipi maggiormente presenti in Italia: SB0415, SB0416, SB0418, SB0866. I 32 ceppi selezionati sono stati sottoposti a:
- Studio fenotipico (10 tra i 22 isolati più diffusi in Italia)
- Studio genotipico (22 isolati di M. caprae più diffusi e 10 caratterizzati da spoligotipi unici)
Studio fenotipico: Per la valutazione della sensibilità alla PZA con i metodi su terreni liquidi specifici per questo test, è stato impiegato inizialmente il metodo radiometrico BACTEC poi sostituito da quello non radiometrico (MIGIT 960, validato solo di recente per il test della PZA).
Allo scopo di approfondire ulteriormente le caratteristiche biochimiche dei M. caprae italiani, è stata anche valutata, mediante Antibiogramma (ATB), la suscettibilità a 4 principi attivi normalmente utilizzati nella terapia antitubercolare in medicina umana.
Il test di sensibilità degli M. caprae a Isoniazide (INH), Streptomicina (STR), Rifampicina (RIF) ed Etambutolo (EMB), è stato effettuato secondo il metodo delle proporzioni su Middlebrook 7H10. Sono state utilizzate differenti concentrazioni dei principi attivi: INH, 0,2 e 1 µg/ml; STR, 2 e 10 µg/ml; EMB, 5 µg/ml; RIF, 1 µg/ml (Figura 3).
Studio genotipico: I principali metodi di identificazione molecolare che permettono di evidenziare i profili genetici tipici di M. caprae sono il test proposto da Huard et al. nel 2003 e l'analisi del gene gyrB, mediante PCR/RFLP descritto da Kasai et al. e Niemann et al. nel 2000, in combinazione con lo Spoligotyping (Spacer Oligonucleotide Typing) (Kamerbeek et al., 1997).
A queste metodiche nel presente studio sono state affiancate l'analisi dei loci ETRA-E (Frothingham R., 1998) e l'analisi del pannello dei 7 marcatori VNTR (2163a, 2163b, 2996, 3155, 4052, 1895, 3232) selezionati nel lavoro di Boniotti et al. (2009). I 32 isolati di M. caprae, su cui è stata effettuata l'analisi della sequenza del gene pncA, erano caratterizzati da una notevole variabilità genetica. Per il sequenziamento del gene pncA sono stati utilizzati i primers P1 e P6 descritti da Barouni et al. (2004).
I prodotti della reazione di sequenza sono stati sottoposti a separazione mediante elettroforesi capillare su sequenziatore automatico ABI-PRISM 3130 o 3500XL (Applied Biosystems).
Le sequenze consensus ottenute sono state allineate con il metodo CLUSTALW, MegAlign software Lasergene (DNASTAR, Madison, USA).
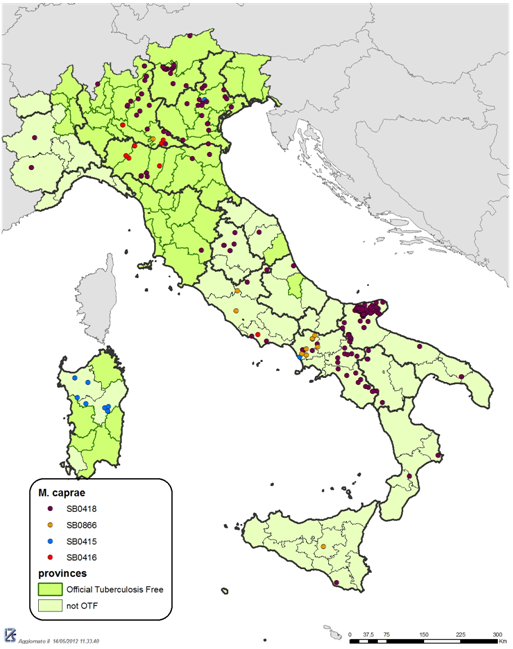
Figura 2 - Distribuzione geografica degli spoligotipi di
M. caprae isolati in Italia negli anni 2000-2011.
(cortesia del Centro di Referenza Nazionale per la Tubercolosi bovina da
Mycobacterium bovis - IZSLER)
Risultati
Studio Fenotipico: Tre dei quattro ceppi di M. caprae testati con il sistema radiometrico hanno mostrato una MIC per PZA inferiore a 12.5 µg/ml, il quarto ha mostrato una MIC di 25 µg/ml.
Alla luce di questi risultati, gli altri 6 ceppi sono stati testati alla concentrazione di PZA di 25 µg/ml risultando tutti sensibili. Per quanto riguarda la valutazione della sensibilità utilizzando il sistema non radiometrico MIGIT 960, i 10 ceppi di M. caprae sono stati testati alla concentrazione di PZA di 25 µg/ml, risultando tutti sensibili. Dallo studio fenotipico per la valutazione della sensibilità/resistenza degli isolati di M. caprae a Isoniazide, Streptomicina, Rifampicina, Etambutolo, non sono emerse resistenze.
Studio genotipico: I 32 isolati di M. caprae italiani analizzati nello studio hanno presentato una sequenza del gene pncA nella sua forma "wild-type", perfettamente sovrapponibile alla sequenza del ceppo di riferimento internazionale di M. caprae gM-1T.
La presenza del nucleotide C alla posizione 169 del gene pncA in tutti i ceppi analizzati, ha confermato la sensibilità alla PZA riscontrata nello studio fenotipico.
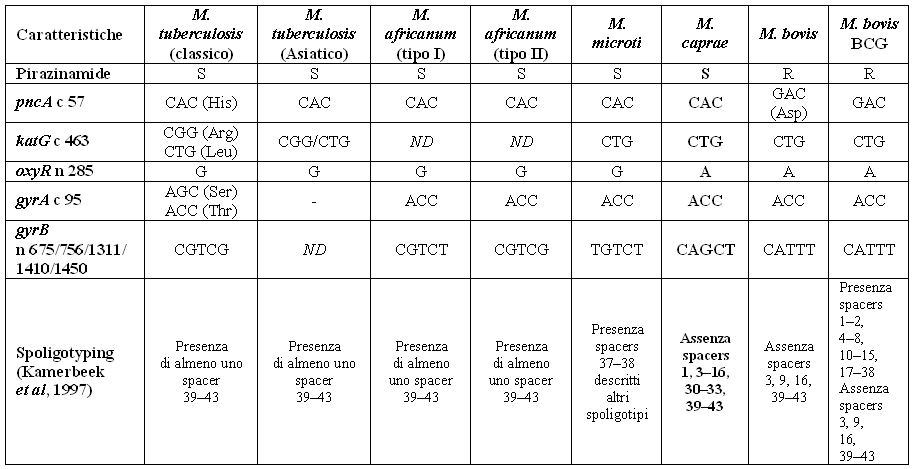
Tabella 1 - Principali caratteristiche differenziali degli isolati di
M. caprae rispetto ad altri membri del
M. tuberculosis complex (modificata da Aranaz et al., 2003).
S: sensibile; R: resistente. Mutazioni sui codoni e nucleotidi dei Geni pncA, katG, oxyR, gyrA, gyrB;
ND: dati non disponibili


Figura 3 - Preparazione del terreno Middlebrook 7H10 per antibiogramma con farmaci antitubercolari,
presso l'Unità Operativa Specialistica Officina Farmaceutica dell'IZSUM
Discussione
L'indagine oggetto di studio ha permesso di:
- effettuare una ricognizione degli isolati clinici di M. caprae circolanti in Italia,
- confermare l'importanza della banca dati del CdRNTb per avere una visione completa dell'epidemiologia molecolare dei ceppi di Micobatteri circolanti nel territorio nazionale.
Le misure di controllo previste dai piani di eradicazione della bTB hanno condotto ad una progressiva riduzione della prevalenza dell'infezione in Italia.
E' opportuno segnalare però che i requisiti sanitari previsti dalla normativa comunitaria (Dir. 97/12/CE, recepita con D.L.vo n. 196 del 22/05/1999) richiedono una percentuale annua di allevamenti infetti da bTB inferiore allo 0,1% negli ultimi 6 anni, quindi il nostro paese non può ancora dichiarare il territorio nazionale ufficialmente indenne da bTB. Al momento si procede attraverso la dichiarazione di indennità su scala provinciale e/o regionale.
In questo contesto legislativo e territoriale assume particolare importanza ricostruire le vie di diffusione e trasmissione della bTB, per individuare aree e fattori di rischio associate alla persistenza dell'infezione nel territorio. A tal fine, negli ultimi anni, all'indagine epidemiologica convenzionale si è affiancata la tipizzazione molecolare dei ceppi di M. bovis e M. caprae isolati, con il risultato di confermare o svelare fonti di contagio diversamente non correlabili. Queste informazioni sono indispensabili per effettuare studi comparativi con le realtà europee ed internazionali.
Per quanto riguarda gli studi di antibiotico resistenza, in micobatteriologia umana, i test vengono eseguiti da personale altamente specializzato. Volendo effettuare indagini simili sui micobatteri isolati nel settore veterinario, bisogna tener conto della complessità delle metodiche disponibili. Per la nostra esperienza sarebbe auspicabile prevedere una formazione specifica per il personale dei laboratori di batteriologia veterinaria, sia per le metodiche su terreni solidi che per quelle su terreni liquidi. In particolare, considerando che apparecchiature come il BACTEC e il MIGIT system non sono facilmente accessibili, in alternativa ci si potrebbe rivolgere direttamente ai laboratori di micobatteriologia umana.
Infine si ritiene necessario chiarire il ruolo del Mycobacterium caprae quale agente eziologico di bTB nell'ambito del panorama normativo italiano e comunitario; infatti a fronte dell'evoluzione tecnico-scientifica avvenuta in questi ultimi anni, che ha definitivamente accertato questo aspetto, non vi è stato un corrispondente aggiornamento della normativa di riferimento di cui le emissioni più recenti risalgono rispettivamente al 1995 e al 1999 con il DM n.592 del 15/12/1995 e il D.L.vo n.196 del 22/05/1999, modificato successivamente dal Regolamento (CE) N. 1226/2002.
Progetto di Ricerca Corrente realizzato con i fondi del Ministero della Salute, RC. 19/09 IZSUM
Bibliografia
Aranaz, A., Cousins, D., Mateos, A. and Lucas Domìnguez, L. (2003) Elevation of Mycobacterium tuberculosis subsp. caprae Aranaz et al. 1999 to species rank as Mycobacterium caprae comb. nov., sp. nov. International Journal of Systematic and Evolutionary Microbiology. 53, 1785-1789.
Barouni AS, Augusto CJ, Lopes MT, Zanini MS, Salas CE. (2004). A pncA polymorphism to differentiate between Mycobacterium bovis and Mycobacterium tuberculosis. Molecular and Cellular Probes (MCP), Jun; 18(3):167-70.
Boniotti, M.B., Goria, M., Loda, D., Garrone, A., Benedetto, A., Mondo, A., Tisato, E., Zanoni, M., Zoppi, S., Dondo, A., Tagliabue, S., Bonora, S., Zanardi,G. and Pacciarini M.L. (2009) Molecular Typing of Mycobacterium bovis Strains Isolated in Italy from 2000 to 2006 and Evaluation of Variable-Number Tandem Repeats for Geographically Optimized Genotyping. Journal of Clinical Microbiology, 47, 636-644.
Brosch, R., S: V. Gordon, M. Marmiesse, P. Brodin, C. Buchrieser, K. Eigelmeier, T. Garnier, C. Gutierrez, G. Hewinson, K. Kremer. L. M. Parsons, A. S. Pym, S. Samper, D. van Soolingen (2002). A new evolutionary scenario for Mycobacterium tuberculosis complex. Proceedings of the National Academy of Sciences, 99: 3684-3689.
Frothingham R, Meeker-O'Connell WA. (1998) Genetic diversity in the Mycobacterium tuberculosis complex based on variable numbers of tandem DNA repeats. Microbiology, 144:1189-96. DOI:10.1099/00221287-144-5-1189.
Huard, R. C., L. C. de Oliveira Lazzarini, W. Ray Butler, D. van Soolingen and J. L. Ho. (2003) PCR-based method to differentiate the subspecies of the Mycobacterium tuberculosis complex on the basis of genomic deletions Journal of Clinical Microbiology, 41, 1637-1650.
Kamerbeek, J., L. Schouls, A. Kolk, M. van Agterveld, D. van Soolingen, S., Kuijper, A., Bunschoten, H. Molhuizen, R. Shaw, M. Goyal, and J. van Embden (1997) Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology. Journal of Clinical Microbiology, 35, 907-914.
Kasai, H., T. Ezaki, and S. Harayama (2000) Differentiation of phylogenetically related slowly growing Mycobacteria by their gyrB sequences. Journal of Clinical Microbiology, 38, 301-308.
Kubica, T., Rüsch-Gerdes, S.,and Niemann, S. (2003) Mycobacterium bovis subsp. caprae Caused One-Third of Human M. bovis-Associated Tuberculosis Cases Reported in Germany between 1999 and 2001. Journal of Clinical Microbiology, 41, 3070-3077.
Niemann, S., D. Harmsen, S. Ru¨sch-Gerdes, and E. Richter (2000) Differentiation of Mycobacterium tuberculosis complex isolates by gyrb DNA sequence polymorphism analysis Journal of Clinical Microbiology, 38,3231-3234.
Affiliazioni
S. Corneli1, M.L. Pacciarini2, M.B. Boniotti2, M.G. Zanoni2, C. Piersimoni3, M. Biagetti1, A. Di Paolo1, G. Curina1, P. Mazzone1
1Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche, Perugia
Centro di Referenza Nazionale per la Tubercolosi bovina da Mycobacterium bovis - Istituto Zooprofilattico
2Sperimentale della Lombardia e dell'Emilia Romagna, Brescia
3Laboratorio Regionale di Riferimento per la diagnostica delle infezioni da Micobatteri - Azienda Ospedaliera Ospedali Riuniti di Ancona






