Biblioteca Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Sanità Pubblica Veterinaria: Numero 109, Agosto 2018 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#685
Sviluppo di un metodo per la determinazione di aminoglicosidi e colistine nel muscolo e nel latte
Development of a method for the determination of aminoglycosides and colistins in meat and milk
Roberta Galarini, Giorgio Saluti, Irene Diamanti, Rosanna Rossi, Simone Moretti, Danilo Giusepponi
Istituto Zooprofilattico Sperimentale Umbria e Marche, "Togo Rosati", Perugia.
Abstract. A very important group of antibiotics, that is aminoglycosides (AG), has peculiar physicochemical properties and as consequence, it is very difficult to include them in multiclass methods. This is essentially due to their high polarity, which cause a remarkable difficulty in separating them by using traditional reversed-phase chromatography, which is generally used to separate the other main families of veterinary drugs (beta-lactams, quinolones, sulfonamides, tetracyclines etc.). The same goes for the colistins (polymyxins) that are very hydrophilic cyclic polypeptides. This is why there are only few routine laboratories performing AG and colistin analysis, meaning that their residues' control on food matrices is rather limited. Therefore the aim of this project was to set up and validate a confirmatory analytical method to determine simultaneously AGs and colistins in meat and milk, according to European Union criteria. Liquid chromatography coupled to a Q-Orbitrap detector has been used as analytical technique. The estimated performance characteristics (linearity, selectivity, accuracy, decision limits, detection capabilities, limits of detection/quantification, ruggedness and stability) were satisfactory in both matrices
Riassunto. Un gruppo molto importante di antibiotici, ovvero quello degli amminoglicosidi (AG), possiede caratteristiche chimico-fisiche tali da non poter essere sostanzialmente incluso in un metodo multiclasse insieme alla maggior parte delle altre famiglie di antibiotici (beta-lattamici, chinolonici, sulfamidici, tetracicline etc.). Questo a causa della loro estrema polarità che rende questi farmaci difficili da estrarre e inadatti ad essere separati tramite le tradizionali strategie cromatografie in fase inversa. Lo stesso vale per le colistine (polimixine) che sono dei polipeptidi ciclici molto idrofili. Ciò premesso, sono pochi i laboratori che effettuano routinariamente l'analisi di queste molecole, limitando di fatto il controllo dei loro residui negli alimenti. L'obiettivo principale del progetto è stato, dunque, quello di mettere a punto e validare, in accordo ai criteri dell'Unione europea, una procedura di conferma per la determinazione simultanea di amminoglicosidi e colistine in carne e latte in accordo ai requisiti dell'Unione europea. La tecnica analitica utilizzata è stata la cromatografia liquida interfacciata ad un analizzatore ibrido in spettrometria di massa ad alta risoluzione (LC-Q-Orbitrap). I parametri determinati (linearità, selettività, accuratezza, limiti di decisione, capacità di rilevazione, limiti di rilevazione/quantificazione, robustezza e stabilità) sono risultati soddisfacenti in entrambe le matrici
Introduzione
Il controllo dei residui di antibiotici negli alimenti di origine animale è un aspetto fondamentale nelle politiche di salute pubblica dell'Unione europea, non solo per problemi di tipo tossicologico, ma anche per il ben noto fenomeno della farmaco-resistenza (EFSA Journal, 2017). Di recente alcuni laboratori hanno sviluppato protocolli capaci di rilevare i residui di più classi di farmaci contemporaneamente mediante tecniche strumentali basate sulla rilevazione in spettrometria di massa. Il fine di questi nuovi approcci è quello di evidenziare, mediante un'unica analisi, una vasta gamma di farmaci utilizzati in allevamento ai livelli richiesti dalle normative vigenti (Regolamento 37/2010).
Questo comporta indubbiamente un miglioramento dell'efficacia dei controlli effettuati durante i piani di monitoraggio ufficiale, superando la tradizionale strategia "one class one test". Tuttavia, nonostante il proliferare di metodi multiclasse tra cui alcuni sviluppati presso il nostro Istituto (Ricerca Corrente RC IZSUM 0022011, 2011; Moretti, Dusi et al. 2016; Moretti, Cruciani et al. 2016), il gruppo degli amminoglicosidi (AG) possiede caratteristiche chimico-fisiche non compatibili con quelle della maggior parte degli altri antimicrobici, quali chinolonici, macrolidi, tetracicline o amfenicoli (Farouk et al. 2015).
Ciò comporta che, sebbene gli AG siano antibiotici largamente utilizzati in medicina veterinaria, la diffusione di metodi per la loro determinazione (anche mono-classe) è limitata, ciò a causa delle difficoltà analitiche dovute alla loro struttura altamente idrofila (simile a quella degli zuccheri) che li rende inadatti ad essere separati tramite le convenzionali colonne LC in fase inversa. Queste caratteristiche complicano anche il trattamento del campione, dato che essi tendono ad instaurare interazioni di legame analita-proteina con difficoltà di estrazione dalle matrici biologiche.
Gli amminoglicosidi sono inclusi da tempo nei Piani Nazionali (PNR) e la Commissione europea ha fissato dei Limiti Massimi di Residuo, LMR (Regolamento 37/2010) in diverse matrici (Tabella 1). Tuttavia il PNR italiano prevede la loro ricerca solo in un numero limitato di campioni, probabilmente anche a causa delle difficoltà tecniche sopra illustrate.
Attualmente esiste l'esigenza di sviluppare procedure che includano tutte gli aminoglicosidi utilizzati in zootecnica e, comunque, tutti quelli per cui è stato fissato un LMR (Tabella 1).
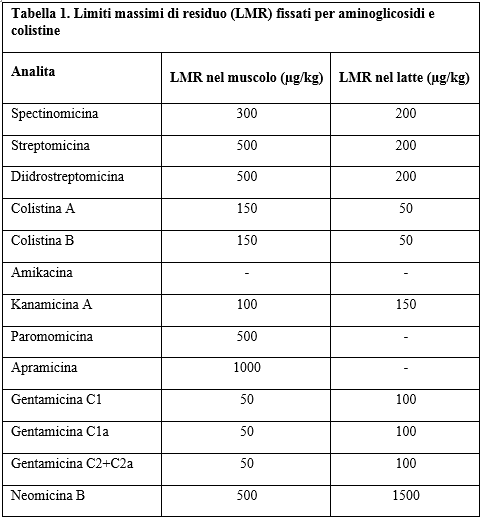
Table 1. Maximum residue limits (MRL) for aminoglycosides and colistins
Ciò è auspicabile anche perché i dati ottenuti nei controlli effettuati in altri paesi indicano che questi antibiotici possono essere frequentemente riscontrati. Ad esempio, dai report quindicinali dei piani di controllo ufficiale pubblicati dal Dipartimento dell'Agricoltura statunitense (USDA), si evince che residui di neomicina sono spesso presenti nei campioni prelevati al mattatoio (USDA, sito web). Per quanto riguarda la tecnica analitica scelta per raggiungere il suddetto obiettivo, data la recente diffusione anche a livello degli Istituti Zooprofilattici Sperimentali, di sistemi di cromatografia liquida interfacciati ad analizzatori in spettrometria di massa ad alta risoluzione (LC-HRMS), la procedura è stata sviluppata mediante questa piattaforma.
A livello globale questo tipo di sistemi è ormai utilizzato anche nell'ambito dei farmaci veterinari quasi quanto i tradizionali apparati con rilevatori triplo quadrupolo (LC-MS/MS). Infine, le particolari caratteristiche degli AG hanno implicato una separazione cromatografica con una colonna di tipo HILIC (Hydrophilic Interaction Liquid Chromatography).
Materiali e metodi
Materiali e reagenti
Amikacina, Apramicina, Colistina A, Colistina B, Diidrostreptomicina, Canamicina A, Neomicina, Paromomicina, Ribostamicina, Spectinomicina, Streptomicina sono stati acquistati dalla Sigma-Aldrich (St. Louis, MO, USA). Gentamicina C1, Gentamicina C1a e Gentamicina C2-C2a sono stati acquistati da TRC Corporation (Lowell, MA, USA). Le vials in vetro per autocampionatore da 1.8 mL provviste di tappo sono della Thermo Scientific (San Jose, CA, USA). L'acetonitrile e il metanolo per LC-MS/MS sono della Sigma-Aldrich (St. Louis, MO, USA) così come l'Na2EDTA (EDTA sale bisodico) e l'ammonio acetato (? 98%). L'acido formico al 100% per LC-MS e l'ammonio formiato per LC-MS sono stati acquistato dalla VWR Chemicals (Lutterworth, UK). L'acido tricloroacetico e il cloruro di sodio sono stati forniti dalla Carlo Erba reagenti (Milano, Italia).
L'acqua ultra-pura (>18 M -cm) è stata prodotta con un sistema Milli-Q (Millipore, Bedford, MA, USA). Le colonnine Sep-Pak® Vac AccellTM Plus CM (500 mg/6 mL) sono state acquistate da Waters (Milford, MA, USA), la colonna cromatografica e la relativa precolonna per HPLC Poroshell 120 HILIC 3.0 x 100 mm 2.7 µm (Agilent Technologies) sono state acquistate da Agilent Technologies (Santa Clara, CA, USA). Soluzione di estrazione per il tessuto muscolare: soluzione acquosa contenente acido tricloroacetico, cloruro di sodio, EDTA e ammonio acetato. Soluzione di estrazione per il latte: soluzione acquosa contenente acido tricloroacetico.
Preparazione del campione
Lo fasi principali del trattamento del campione sono riportate in Figura 1.
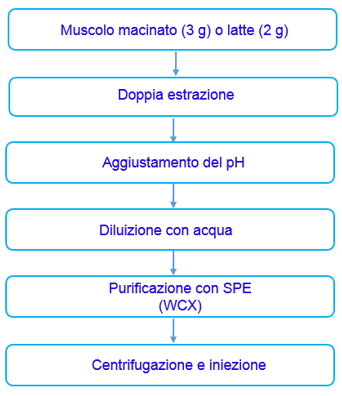
Figura 1. Schema di trattamento del campione per la matrice muscolo e la matrice latte
Figure 1. Sample treatment scheme: muscle matrix and milk matrix
Validazione del metodo
Lo schema di validazione è stato pianificato per entrambe le matrici su sei livelli successivi di fortificazione uguali per tutti gli analiti. La scelta dei livelli si è basata sugli LMR esistenti facendo in modo che questi rientrassero all'interno dell'intervallo di concentrazioni investigato. Gli esperimenti sono stati effettuati utilizzando muscolo e latte bovino valutando quindi selettività, linearità (in solvente e in matrice), precisione (ripetibilità e riproducibilità intra-laboratorio), recupero (esattezza), limite di decisione (CCα), capacità di rilevazione (CCβ), limite di rivelazione (LOD) e limite di quantificazione (LOQ). Lo schema dettagliato è riportato in Tabella 2.
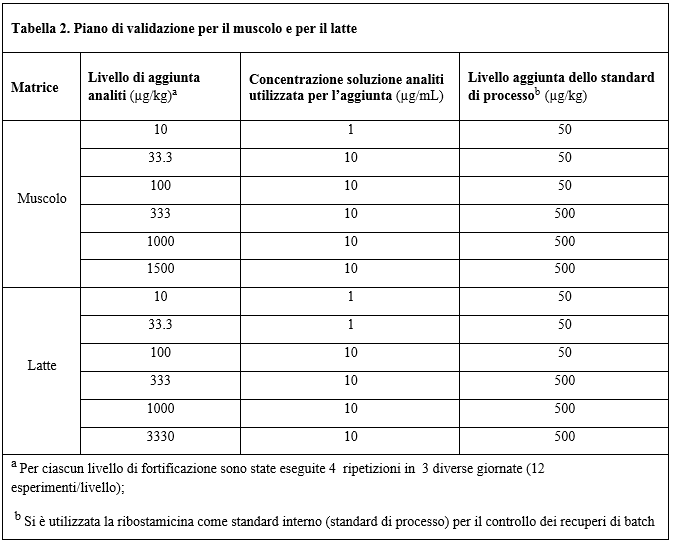
Table 2. Validation plan for muscle and milk
Si è anche valutata la robustezza rispetto alla specie animale ("major changes"), eseguendo prove su carne suina e di pollo (4 repliche in due diverse giornate per un totale di 8 prove a specie). Sono stati anche analizzati "test materials" (muscolo bovino e suino) conservati in congelatore reperiti in seguito alla partecipazione del laboratorio a tre circuiti (anni 2014, 2016 e 2017) organizzati dal Rikilt (Wageningen, NL) per l'analisi multiclasse di antibiotici. Infine si è studiata anche la stabilità in soluzione dei 14 analiti. L'analisi dei dati è stata condotta mediante i pacchetti Microsoft Excel® e Stata 11.2 (Stata Corp LLC, Lakeway Drive College Station, TX, USA).
Condizioni strumentali
Le analisi sono state effettuate mediante un sistema HPLC Ultimate 3000 - Thermoscientific (San Jose, CA, USA) dotato di un rilevatore di massa ibrido (Q-Exactive, Thermoscientific), eseguendo un'unica corsa cromatografica in modalità positiva (ESI+). La separazione cromatografica è stata sviluppata su una colonna tipo HILIC (Poroshell 120 HILIC 100 x 2.1 mm, 2.7 µm, Agilent Technologies).
Risultati
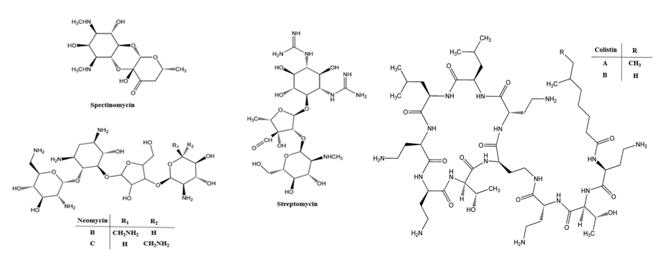
In Figura 2 sono riportate le strutture tipiche degli analiti appartenenti alla classe degli amminoglicosidi e delle colistine in cui si evidenziano le peculiarità strutturali di questi composti estremamente polari.
CLICCARE SULL'IMMAGINE PER INGRANDIRLA
Figura 2. Strutture di tre amminoglicosidi (sinistra) e della colistine A e B (destra)
Figure 2. Structures of three aminoglycosides (left); A and B colistine (right)
Inoltre, la presenza di gruppi amminici (da un minimo di due per la spectinomicina fino a sei per la neomicina) conferisce a tutti i composti un'elevata basicità.
Durante le prime fasi di svolgimento del progetto, visto l'interesse e le potenzialità per un loro inserimento, si è cercato di sviluppare una procedura in grado di includere, oltre agli aminoglicosidi, anche gli antibiotici polipeptidici colistina e bacitracina. Questo inserimento è stato attuato con successo per le colistine A e B, mentre per la bacitracina non si sono avuti esiti favorevoli.
Lo sviluppo delle condizioni strumentali ha comportato una serie di difficoltà legate soprattutto alla separazione cromatografica. Infatti, visto che non si potevano usare colonne con meccanismo in fase inversa, per la prima volta nel nostro laboratorio sono state testate fasi stazionarie di tipo HILIC, ovvero basate su una cromatografia ad interazione idrofilica. L'HILIC è sostanzialmente un'estensione della cromatografia in fase normale che si avvale però di fasi mobili acquose (acqua o tampone) e solventi organici miscibili in acqua quali l'acetonitrile. Le fasi stazionarie sono sostanze adsorbenti polari altamente idrofile come fasi silicee non derivatizzate, impaccamenti polimerici polari, fasi dioliche e ammidiche legate e scambiatori ionici (Buszewski e Noga, 2012).
Il fattore comune è che tutte possono facilmente adsorbire acqua, da cui la classificazione di "idrofile". Mediante questo tipo di cromatografia è stato possibile ottenere dei tempi di ritenzione per le varie sostanze compresi tra 5 e 7 minuti. Si è poi affrontata l'ottimizzazione del protocollo di trattamento del campione, partendo dal lavoro di Kumar e collaboratori (Kumar et al. 2012) che descriveva un metodo multiresiduo per la determinazione di undici aminoglicosidi nel rene e nel miele.
Inizialmente si è lavorato sulla matrice muscolo, valutando la quantità di materiale da processare, le miscela di estrazione e le modalità di purificazione. Tra gli approcci proposti in letteratura per la purificazione degli estratti, si è scelta la Solid Phase Extraction basata su una fase stazionaria a scambio cationico debole (SPE-WCX). Infatti questo tipo di fase era quella che sulla carta poteva dare i migliori risultati anche nell'ottica di determinare entrambe le due classi di farmaci.
Si è quindi giunti al protocollo schematizzato in Figura 1. Al termine dello studio di validazione nel muscolo, si è passati al trasferimento alla matrice latte. In questa fase sono state necessarie alcune modifiche relativamente alla quantità di materiale processato (due grammi invece di tre) e soprattutto alla composizione della miscela di estrazione. Tali modifiche sono state apportate soprattutto a causa della peculiare composizione del latte con un alto contenuto di sali (8000-9000 ppm) che condizionava fortemente il recupero di alcune delle molecole di interesse (in particolare la spectinomicina).
Per entrambe le matrici la validazione è avvenuta in accordo alla Decisione della Commissione 2002/657/CE, verificando anche il rispetto dei criteri di identificazione strumentali indicati nella più aggiornata lineaguida "Guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed" (SANTE/11945/2015). I coefficienti di variazione stimati in condizioni di riproducibilità intralaboratorio (CVwR) ai singoli livelli di validazione sono stati calcolati tramite ANOVA elaborando le 12 repliche a disposizione nelle tre giornate di lavoro (Tabella 2).
Il limite di decisione (CCα) e la capacità di rilevazione (CCβ) sono stati poi calcolati utilizzando i valori dei CVwR moltiplicati per il fattore previsto (1.64). Il limite di rilevazione (LOD) e di quantificazione (LOQ) sono stati stabiliti sulla base dei dati di accuratezza ottenuti al primo (10 µg/kg) o, se non soddisfacenti, al secondo livello di validazione (33 µg/kg). Allorquando per un analita non sia stato fissato un LMR come, ad esempio, per la paromomicina e l'apramicina nel latte (Tabella 1), è il LOD a fungere da limite di decisione per la dichiarazione di non conformità /conformità del campione. Sulla base dei risultati, si può affermare che il metodo è idoneo per la determinazione dei 14 farmaci nel muscolo e nel latte bovino sia da un punto di vista qualitativo che quantitativo. Gli esperimenti replicati su campioni di carne appartenenti ad altre specie animali (suino e pollo) hanno dimostrato che le performances non risentivano della specie analizzata. A ulteriore conferma, si è applicata la procedura qui sviluppata a dei "test materials" (muscoli bovini e suini) provenienti da "proficiency test" disponibili in laboratorio in seguito alla partecipazione in anni precedenti a circuiti interlaboratorio per la determinazione di altri classi di antimicrobici (Moretti, Dusi et al. 2016). Questi materiali, infatti, secondo la dichiarazione dell'organizzatore, contenevano anche molecole di amminoglicosidi (diidrostreptomicina, kanamicina e spectinomicina). I risultati sono stati molto soddisfacenti in quanto non si sono registrati né falsi negativi, né falsi positivi. Le concentrazioni stimate dal laboratorio hanno fornito valori di z-score sempre compresi tra -2.0 e 2.0.
Discussione e prospettive future
I risultati preliminari di questo lavoro di ricerca sono stati presentati in congressi nazionali (Saluti et al. MASSA 2016, 2016; Saluti et al. 2th MS Nat Med Day, 2017) ed internazionali (Natalini et al. PBA, 2017; Saluti et al. RAFA, 2017). Inoltre, è stato già sottomesso un lavoro ad una rivista internazionale (Saluti et al. dicembre 2017). Sulla base delle nostre conoscenze, quella qui sviluppata è la prima procedura in grado di determinare simultaneamente dodici amminoglicosidi e due colistine nella carne e nel latte ai livelli richiesti (Regolamento 37/2010). L'inserimento anche delle due colistine rappresenta un notevole valore aggiunto anche alla luce del fatto che queste sostanze rappresentano ormai un problema di sanità pubblica per via del moltiplicarsi di casi in cui si segnalano fenomeni di antibiotico-resistenza imputabili al loro utilizzo in allevamento (EMA, 2016).
Riguardo alla qualità del dato e alla carenza di metodi in questo ambito, se i circuiti interlaboratorio organizzati per gli AG negli alimenti non sono numerosi, addirittura, per le colistine, non ci risulta che ne siano stati mai organizzati. Questo aspetto sarebbe da rafforzare poiché la disponibilità di esercizi interlaboratorio è "condicio sine qua non" per il miglioramento dei metodi e per la loro diffusione. Sicuramente la diffusione è anche condizionata dalla difficoltà intrinseca della sfida analitica e dalla necessità di utilizzare procedure separate rispetto alla maggior parte degli altri farmaci veterinari con un impiego di risorse strumentali importanti anche per via del fatto che attualmente non è possibile impiegare tecniche alternative alla LC-MS, neanche al solo scopo di screening. Infine, si rileva che non sono state mai adeguatamente investigate quali siano le condizioni ottimali per estrarre quantitativamente questi farmaci dalle matrici biologiche (rottura dei legami tra aminoglicosidi e proteine e tra colistine e fosfolipidi) e sarebbe auspicabile una ricerca in questo senso utilizzando campioni naturalmente contaminati ("incurred").
Bibliografia
Buszewski B., Noga S. (2012). Hydrophilic interaction liquid chromatography (HILIC)--a powerful separation technique. Analytical and Bioanalytical Chemistry, 402, 231-247.
Decisione della Commissione 2002/657/CE del 12 agosto 2002 che attua la direttiva 96/23/CE del Consiglio relativa al rendimento dei metodi analitici e all'interpretazione dei risultati (Gazzetta ufficiale dell'Unione europea L 221/8 del 17.08.2002).
EFSA (European Food Safety Authority), European Centre for Disease Prevention and Control (2017). The European Union summary report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in 2015 (scientific report). EFSA Journal. 15(2) 4694.
EMA (European Medicine Agency). (2016). Updated advice on the use of colistin products in animals within the European Union: development of resistance and possible impact on human and animal health". EMA/231573/2016.
Farouk F., Azzazy H.M.E., Niessen W.M.A. (2015). Challenges in the determination of aminoglycoside antibiotics, a review. Analytica Chimica Acta, 890, 21-43.
Kumar P., Rúbies A., Companyó R., Centrich F. (2012). Determination of aminoglycoside residues in kidney and honey samples by hydrophilic interaction chromatography-tandem mass spectrometry. Journal of Separation Science, 35, 2710-2717.
Moretti S., Dusi G., Giusepponi D., Pellicciotti S., Rossi R., Saluti G., Cruciani G., Galarini R. (2016). Screening and confirmatory method for multiclass determination of 62 antibiotics in meat. Journal of Chromatography A, 1429, 175-188.
Moretti S., Cruciani G., Romanelli S., Rossi R., Saluti G., Galarini R. (2016). Multiclass Method for the Determination of 62 Antibiotics in Milk. Journal of Mass Spectrometry, 51, 792-804.
Natalini B., Ianni F., Pucciarini L., Carotti A., Saluti G., Moretti S., Galarini R., Sardella R. (2017). Hydrophilic Interaction Liquid Chromatography of Aminoglycoside Antibiotics" 28th Pharmaceutical and Biomedical Analysis Conference (PBA 2017), Madrid (Spagna), July 2-5.
Regolamento (UE) 37/2010 della Commissione del 22 dicembre 2009 concernente le sostanze farmacologicamente attive e la loro classificazione per quanto riguarda i limiti massimi di residui negli alimenti di origine animale (Gazzetta ufficiale dell'Unione europea L15/1 del 20.01.2010).
Ricerca Corrente RC IZSUM 0022011 (2011). Dai metodi multiresiduo ai multiclasse: sviluppo di protocolli innovativi nel campo della ricerca dei residui di farmaci veterinari negli alimenti" finanziata dal Ministero della Salute, 2011.
Saluti G., Moretti S., Romanelli S., Rossi R., Sardella R., Galarini G. (2016). Development of a method for the determination of aminoglycoside and polypeptide antibiotics in food: preliminary results". Massa 2016, Roma 6-8 Settembre.
Saluti G., Diamanti I., Ianni F., Rossi R., Giusepponi D., Moretti S., Sardella R., Galarini R., (2017). Determination of aminoglycoside and colistin residues in meat by HILIC-LC-HRMS", 2nd NatMed Day Aboca, Sansepolcro (AR), June 28-30.
Saluti G., Diamanti I., Ianni F., Rossi R., Giusepponi D., Moretti S., Sardella R., Galarini R. (2017). Aminoglycoside and colistin residues in food by HRMS". 8th International Symposium of RAFA (Recent Advances In Food Analysis), Prague (CZ), November 7-11.
Saluti G., Diamanti I., Giusepponi D., Pucciarini L., Moretti S., Rossi R., Sardella R., Galarini R. (2017). Simultaneous determination of aminoglycosides and colistins in food. Food Chemistry, 266 (2018) 9–16.
SANTE/11945/2015. Guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed. (2015).
USDA (United States Department of Agriculture) www.fsis.usda.gov

Galarini et al, 2018 - Sviluppo di un metodo per la determinazione di aminoglicosidi e colistine nel muscolo e nel latte (SPVet.it 109/2018)





