Biblioteca Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
Sanità Pubblica Veterinaria: Numero 106, Febbraio 2018 [http://www.spvet.it/] ISSN 1592-1581
Documento reperibile all'indirizzo: http://spvet.it/indice-spv.html#676
Valutazione dell'antimicoticoresistenza in miceti di interesse medico e veterinario isolati in Umbria: risultati ricerca corrente IZSUM 04/2014
Evaluation of the antimycotic resistance in fungi isolated in Umbria (Italy) from man and animals: results of the current research IZUM 04/2014
Elisa Sgariglia1, Lucia Pitzurra2, Marinella Capuccella1, Fabrizio Passamonti3, Annamaria Tortorano4, Alessia Franco5,Francesco Agnetti1
1 Istituto Zooprofilattico Sperimentale dell'Umbria e delle Marche
2 Dipartimento di Medicina Sperimentale, Sezione di Microbiologia, Università degli Studi di Perugia
3 Dipartimento di Medicina Veterinaria, Università degli Studi di Perugia
4 Dipartimento di Scienze Biomediche per la Salute, Università degli Studi di Milano
5 Istituto Zooprofilattico Sperimentale Lazio e Toscana
Abstract. In the last twenty years, several studies showed a greater interest in the field of fungal disease both in human and veterinary medicine, also because some mycoses are zoonoses. Since this background, by a "one health approach" point of view, therapy is definitely a critical point in managing a mycotic pathology. Indeed, fungal infections are still often difficult to diagnose and, above all, to be handled, particularly in the case of strains that are resistant to common antifungal drugs. Aim of this research project (RC IZSUM 04/2014) were:
- isolation, identification and evaluation of the sensitivity to the antimycotics of fungi isolated from human and various animal species;
- characterization of the isolates by molecular methods and mass spectrometry (MALDI-TOF);
- standardization of the test of susceptibility to antifungal drugs for animal strains, both for filamentous fungi and yeast;
- study about the resistance factors, with particular reference to animal strains;
- dissemination of the results on national and international papers and/or conference proceedings.
Samples were collected both from human and animals and subsequently incubated according to the mycology lab standards, once they were in the laboratory under sterility and within 24 hours of collection. After the appropriate incubation time, colonies were identified on the basis of morphological (macroscopic and microscopic), biochemical (micro method galleries - API® and Vitek II®), molecular (PCR and sequencing) and mass spectrometry (MALDI-TOF) features. The molecular typing of yeast, dermatophytes and non-dermatophytic molds was performed by PCR and sequencing. In parallel, the same samples were analyzed using MALDI-TOF MS technique. The fungal identification methods were subsequently compared using statistical tests. The sensitivity to antimycotics and determination of MIC values (using broth Sensititre Y010 plates, microdilution according to EUCAST and molecular technique for the research for genetic resistance mutations) were evaluated. During the research period, a total of 2,188 fungal strains were collected, of which: 2,114 yeast, 38 dermatophytes and 36 non-dermatophytic molds. The most fungal species isolated were Candida albicans, Microsporum canis and Aspergillus fumigatus.
From a general point of view about the antifungal sensitivity, the various isolated fungi showed resistance rates on average in line with those reported by other authors; exceptions were found in the following cases:
- high percentage of resistance (50%) to Fluconazole in Candida isolates of animal origin;
- low levels of resistance (4.6%) in Candida isolates of both human and animal origin with respect to 5-fluorocytosin;
- variability in the percentage of resistance of Aspergillus to Amphotericin B;
- almost total resistance of dermatophytes, both from human and animal origin, to 5-fluorocytosin (87%)
Riassunto. Negli ultimi vent'anni, si è assistito ad un incremento di interesse nei confronti delle patologie fungine, sia in campo medico che veterinario, anche per il fatto che alcune micosi sono delle zoonosi. Inoltre, soprattutto in ambito umano, la maggiore attenzione alla problematica è pure dovuta ai progressi della medicina di base nonché alla comparsa e diffusione di patologie immunosoppressive (es. HIV) in grado di "predisporre" l'ospite all'insorgenza di micosi. A fronte di ciò, nell'ottica di un approccio "one health", la terapia è sicuramente un punto critico nella gestione di una patologia ad eziologia micotica. Infatti, ancora oggi, le infezioni fungine risultano spesso difficili da diagnosticare e, soprattutto, da gestire, in particolare nei casi in cui vengano isolati ceppi che si rivelano resistenti ai comuni farmaci antimicotici. Gli obiettivi del presente progetto di Ricerca Corrente (RC IZSUM 04/2014) sono stati:
- isolamento, identificazione e valutazione della sensibilità agli antimicotici di miceti da matrici umane e da varie specie animali;
- caratterizzazione degli isolati attraverso metodiche molecolari ed in spettrometria di massa (MALDI-TOF);
- standardizzazione del metodo antimicogramma per ceppi di origine animale, sia per funghi filamentosi che lieviti;
- studio dei fattori di resistenza, con particolare riferimento ai ceppi di origine animale;
- divulgazione dei risultati su riviste e/o atti congressuali di carattere nazionale ed internazionale.
I campioni oggetto di questo progetto, provenienti sia da matrici di origine umana che animale, una volta pervenuti in laboratorio, sono stati seminati su specifici terreni colturali e successivamente incubati secondo gli standard di laboratorio previsti per i miceti. La valutazione morfologica delle colonie si è basata sull'osservazione di caratteri macro-e microscopici, mentre la tipizzazione molecolare di lieviti, dermatofiti e muffe non dermatofitiche attraverso PCR e sequenziamento. In parallelo, i medesimi campioni sono stati analizzati con tecnica MALDI-TOF MS. Le metodiche di identificazione fungina sono state successivamente confrontate attraverso l'utilizzo di test statistici. Sui ceppi micotici isolati e tipizzati secondo quanto descritto in precedenza, si è proceduto alla valutazione della sensibilità agli antimicotici e determinazione dei valori di MIC, attraverso metodo semiautomatico di microdiluizione in brodo (Sensititre Y010), di microdiluizione secondo EUCAST e mediante tecnica molecolare per la ricerca di mutazioni a carico dei geni responsabili della resistenza. Durante il periodo della ricerca sono stati raccolti un totale di n.2188 ceppi fungini di cui: n.2114 lieviti, n.38 dermatofiti e n.36 muffe non dermatofitiche. Le specie fungine maggiormente isolate sono state Candida albicans, Microsporum canis e Aspergillus fumigatus.
Da un punto di vista generale della sensibilità agli antifungini, i vari miceti isolati hanno mostrato tassi di resistenza mediamente in linea rispetto a quelli riportati da altri autori, ad eccezione di un'elevata percentuale di resistenza verso il Fluconazolo negli isolati di Candida di origine animale, di bassi livelli di resistenza negli isolati di Candida (sia di origine umana che animale) nei confronti di 5-fluorocitosina, di una variabilità nella percentuale di resistenza ad Amfotericina B da parte di Aspergillus e della quasi totale resistenza dei dermatofiti (sia di origine umana che animale) nei confronti della 5-fluorocitosina
Introduzione
I funghi sono organismi eucarioti rappresentati, approssimativamente, da circa 300.000 diverse specie. Di queste, circa 200 sono potenzialmente in grado di esercitare parassitismo, ma soltanto poche specie risultano patogene sia per l'uomo che per gli animali, potendo comportarsi sia come patogeni primari che come opportunisti.
Le patologie ad eziologia fungina riguardanti i mammiferi, ossia le micosi, spaziano dalle più comuni infezioni cutanee o sottocutanee (es. dermatofitosi), fino ad arrivare alle infezioni dei tessuti più profondi, o a quelle sistemiche, alcune delle quali potenzialmente letali. Gli studi e le ricerche di micologia medica e dei relativi patogeni hanno visto, negli ultimi vent'anni, un'esplosione di interesse sia in campo medico che veterinario, anche per il fatto che alcune micosi sono delle zoonosi.
Inoltre, soprattutto in ambito umano, la maggiore attenzione alla problematica è pure dovuta ai progressi della medicina di base nonché alla comparsa e diffusione di patologie immunosoppressive (es. HIV) in grado di "predisporre" l'ospite all'insorgenza di micosi.
In altre parole, la micologia medica è cresciuta di pari passo con la crescita in numero e gravità degli ospiti immunocompromessi. A fronte di ciò, nell'ottica di un approccio congiunto al problema tra medico e veterinario, accanto ad aspetti di ordine epidemiologico, eziologico e clinico, quello terapeutico è sicuramente un punto critico nella gestione di una patologia ad eziologia micotica. Seppure, infatti, la ricerca sui composti antifungini abbia subito una notevole espansione, portando alla produzione di nuove classi di molecole altamente efficaci nei confronti di diverse famiglie di miceti, ed, inoltre, l'aumento di consapevolezza della pandemia fungina da parte della comunità medico-veterinaria abbia condotto ad un notevole miglioramento nella definizione delle strategie terapeutiche da adottare nella pratica.
Tuttavia, ancora oggi, le infezioni fungine risultano spesso difficili da diagnosticare e, soprattutto, da gestire, specie in relazione alla possibilità che i ceppi responsabili siano resistenti ai comuni farmaci antimicotici.
Una scarsa risposta alla terapia antifungina può essere dovuta a diversi fattori, quali stato immunitario del paziente, sito e gravità dell'infezione, presenza di corpi estranei come cateteri o trapianti vascolari, reazione del trapianto verso l'ospite (graft versus host), età, stato nutrizionale e scarsa compliance del paziente; altri fattori possono essere inerenti a caratteristiche del farmaco stesso, come l'attività fungistatica o fungicida del farmaco nel sito dell'infezione, la dose e la durata della terapia, il tipo di molecola e l'interazione con altri farmaci.
E' quindi opportuno considerare la resistenza nei confronti di un dato composto antimicotico come la capacità del micete di persistere nell'organismo e causare infezione nonostante la somministrazione di concentrazioni tollerabili del composto stesso.
Il fenomeno della resistenza agli antifungini sembra essere anche strettamente legato all'impiego estensivo di tali sostanze nel trattamento delle infezioni micotiche. Sebbene tale caratteristica sia stata descritta in varie specie, come Aspergillus sp., quella mostrata dal genere Candida costituisce oggi il problema più significativo in campo micologico.
Accanto al genere Candida, però, anche altri lieviti, isolati da campioni clinici sia di origine umana che animale, mostrano comportamenti di resistenza agli antimicotici, tra cui i generi Cryptococcus, Malassezia e Rhodotorula.
Diversamente da quanto avviene per i batteri con gli antibiotici, nei lieviti la resistenza agli antimicotici non emerge rapidamente e non si diffonde con facilità, a causa della natura eucariotica delle cellule, del tempo di replicazione più lungo e della mancanza di meccanismi genetici per lo scambio di resistenze.
Nei lieviti sono pertanto individuabili due forme di resistenza: una innata, presente anche prima della somministrazione di terapie antifungine (es. Candida krusei verso fluconazolo), ed una secondaria o acquisita, che insorge durante o in seguito ad un trattamento antimicotico (es. ceppi di Candida albicans verso composti azolici). Scarsi sono invece i dati relativi alla resistenza agli antimicotici da parte di funghi filamentosi, sia in campo umano che veterinario.
In tale contesto, il progetto si è proposto quindi di valutare l'eventuale riscontro di antimicotiresistenza nei confronti dei comuni antimicotici in uso, sia in ambito medico che veterinario, da parte di ceppi fungini isolati in Umbria, a partire da campioni clinici di origine umana ed animale, e di studiarne i fattori di resistenza. Questo perché, contrariamente a quello che avviene nella medicina umana, dove l'esecuzione di antimicogrammi è notoriamente una pratica diffusa ed effettuata in ambito ospedaliero, in medicina veterinaria tali tematiche stanno ottenendo ancora scarso riscontro e molto spesso la patologia fungina risulta sottostimata o comunque affrontata esclusivamente dal punto di vista clinico, con impostazione di terapie "ad effetto".
Materiali e Metodi
I campioni di origine umana sono stati processati principalmente dal laboratorio di Micologia, presso il Dip.to di Medicina Sperimentale e Scienze Biochimiche. Sez. di Microbiologia, università degli Studi di Perugia/Azienda Ospedaliera S. Maria della Misericordia di Perugia; tali campioni sono derivati sia da pazienti ricoverati presso l'Ospedale, sia da pazienti sottoposti a visite specialistiche in ambulatori che afferiscono all'Ospedale per quanto concerne le analisi micologiche. I campioni di origine animale sono stati prelevati principalmente da animali da compagnia (convenzionali e non) e da animali selvatici-sinantropi.
Quelli provenienti dai pets sono derivati sia da soggetti morti sottoposti a necroscopia presso l'Istituto Zooprofilattico Sperimentale Umbria e Marche - Sezione di Terni, che da soggetti vivi, sottoposti a visita dermatologica presso l'Ospedale Veterinario Didattico del Dipartimento di Medicina Veterinaria di Perugia o in altri ambulatori privati, afferenti al Dipartimento per quanto riguarda le analisi micologiche; i campioni provenienti invece da animali selvatici-sinantropi sono stati raccolti da soggetti abbattuti nell'ambito di programmi di controllo/eradicazione sul territorio, oppure da soggetti rinvenuti morti e pervenuti per indagini necroscopiche, sempre presso la sezione di Terni dell'IZSUM.
I campioni di origine animale sono stati corredati da scheda anamnestica, nella quale sono state riportate tutte le informazioni relative a segnalamento dell'animale, tipologia delle lesioni, eventuale trattamento terapeutico effettuato ed infine l'eventuale comparsa di lesioni a carico del proprietario. In fase di predisposizione del campionamento, è stata redatta da parte del Centro Regionale di Farmacovigilanza veterinaria dell'IZSUM un'apposita scheda di registrazione dei trattamenti antimicotici effettuati, da distribuire alle varie strutture veterinarie operanti nel territorio oggetto di indagine; nella suddetta scheda, oltre ad informazioni relative all'animale e alla/e molecola/e impiegate, è stato richiesto anche di riportare eventuali reazioni avverse e/o mancata efficacia al trattamento.
Il campionamento è stato effettuato tramite tecnica dello spazzolamento e/o tramite l'impiego di pinze, bisturi e/o tamponi sterili e i campioni sono stati conservati in contenitori e/o sacchetti sterili fino a che, una volta pervenuti in laboratorio entro le 24 ore successive al prelievo, sono stati seminati su specifici terreni colturali (agar destrosio Sabouraud e Dermasel agar) al fine di consentire la crescita delle colonie e di apprezzarne alcune caratteristiche (tempo di sviluppo, profilo, morfologia, colore, etc.).
Le piastre sono state successivamente incubate secondo gli standard di laboratorio previsti per i miceti (in aerobiosi a 25±1°C per i campioni derivanti da cute e annessi e a 37±1°C per tutti gli altri campioni organici) ed osservate quotidianamente fino ad un massimo di 10-15 giorni. Trascorso l'adeguato tempo di incubazione, durante il quale sono state effettuate subcolture per ottenere in purezza gli isolati potenzialmente interessanti, si è proceduto all'identificazione delle colonie sulla base di criteri morfologici (macroscopici e microscopici), biochimici (gallerie in micro metodo manuali e automatizzate- API® e Vitek II®), molecolari (PCR e sequenziamento) e in spettrometria di massa (MALDI-TOF).
Relativamente ai criteri morfologici, l'osservazione macroscopica ha posto attenzione ai parametri, tessitura, profilo, colore e consistenza, sia della superficie che del fondo delle colonie. Per la valutazione dei parametri microscopici si è proceduto stemperando su un vetrino portaoggetti un frammento di colonia in soluzione fisiologica o in blu di metilene, e successivamente osservando il preparato al microscopio ottico a diversi ingrandimenti (10X, 40X, 100X).
Relativamente ai lieviti, l'identificazione morfologica è stata affiancata da quella biochimica, attraverso l'uso di gallerie in micrometodo (API Biomeriux®) e, in alcuni casi, attraverso metodo automatizzato (Vitek II®).
La tipizzazione molecolare delle colonie isolate è stata eseguita secondo vari protocolli (Tabella 1. Primers utilizzati per identificazione molecolare dei ceppi fungini) a seconda della tipologia di micete isolato.

Table 1. Primers used for molecular identification of fungal strains
Per quanto riguarda i dermatofiti è stata seguita la procedura descritta da Cafarchia et al., 2013 che prevede: volume totale di 50µl comprendente PCR Buffer 1x, 1.25mM di MgCl2, 0.25 mM di dNTPs, 0.5 µM di ogni primer, 1.25 U di Taq Hot Start (Promega®) e 3 µL di DNA. I prodotti di PCR sono stati analizzati mediante corsa su gel elettroforetico al 2% di agarosio e visualizzato tramite colorante Midori Green Advance DNA stain (NIPPON Genetics®). I prodotti di PCR sono stati purificati usando QIAquick PCR Purification Kit (Qiagen®) e il sequenziamento è stato allestito in entrambe le direzioni con i primers DMTF18SF1 e DMTFITS1R, attraverso BigDye Teminator v1.1 Cycle Sequencing Kit, in accordo con il manuale di istruzioni; le reazioni sono state separate attraverso un ABI PRISM 310 Genetic Analyzer (Applied Biosystems®). Le sequenze sono state create con BioEdit Sequence Alignment Editor software v 7.0.9.0 e successivamente allineate su Genbank database.
Per quanto concerne le muffe non dermatofitiche si è seguito il protocollo di Larena et al., 1999, che prevede un'amplificazione del DNA in 50 µL di volume totale comprendente: PCR Buffer 1X, 1.5 mM di MgCl2, 0.25 mM di dNTPs, 0.5 µM di ogni primer, 1.25 U di Taq Hot Start (Promega®) e 3 µL di DNA. I prodotti di PCR sono stati analizzati mediante corsa su gel elettroforetico al 2% di agarosio e visualizzato tramite colorante Midori Green Advance DNA stain (NIPPON Genetics®). I prodotti di PCR sono stati purificati usando QIAquick PCR Purification Kit (Qiagen®) e il sequenziamento è stato allestito in entrambe le direzioni con i primers ITS4 e ITS5, attraverso BigDye Teminator v1.1 Cycle Sequencing Kit, in accordo con il manuale di istruzioni; le reazioni sono state separate attraverso un ABI PRISM 310 Genetic Analyzer (Applied Biosystems®). Le sequenze sono state create con BioEdit Sequence Alignment Editor software v 7.0.9.0 e successivamente allineate su Genbank database.
Infine nei lieviti l'amplificazione del DNA è stata eseguita su un volume totale di 50µl, secondo il protocollo di Shiang et al., 2016, che comprende: PCR Buffer 1x, 2.5mM di MgCl2, 0.25 mM di dNTPs, 0.5 µM di ogni primer, 2.5 U di Taq Hot Start (Promega®) e 3 µL di DNA. I prodotti di PCR sono stati analizzati mediante corsa su gel elettroforetico al 2% di agarosio e visualizzato tramite colorante Midori Green Advance DNA stain (NIPPON Genetics®). I prodotti di PCR sono stati purificati usando QIAquick PCR Purification Kit (Qiagen®) e il sequenziamento è stato allestito in entrambe le direzioni con i primers NL1 e NL2, attraverso BigDye Teminator v1.1 Cycle Sequencing Kit, in accordo con il manuale di istruzioni; le reazioni sono state separate attraverso un ABI PRISM 310 Genetic Analyzer (Applied Biosystems®). Le sequenze sono state create con BioEdit Sequence Alignment Editor software v 7.0.9.0 e successivamente allineate su Genbank database.
In parallelo, i medesimi campioni sono stati analizzati con tecnica MALDI-TOF MS, utilizzando l'apparecchio MicroFlex LT system (Bruker®) e seguendo il protocollo di Buchanan e Ledeboer (2013) per i lieviti e quello di Saffert et al. (2011) per i dermatofiti e le muffe non dermatofiti che.
Le colonie isolate ed identificate sono state inoltre sottoposte a valutazione della sensibilità agli antimicotici e determinazione dei valori di MIC mediante:
- metodo semiautomatico di microdiluizione in brodo (Sensititre Y010);
- metodo di microdiluizione in brodo secondo linee guida EUCAST;
- metodo automatizzato mediante cards (Vitek II, BioMerieux).
Relativamente al metodo semiautomatico di microdiluizione in brodo (Sensititre Y010), le molecole antifungine testate sono state: Amfotericina B, 5-fluorocitosina, Fluconazolo, Itraconazolo, Voriconazolo, Posaconazolo, Caspofungina, Anidulafungina e Micafungina.
Il pattern osservato sulla piastra è stato poi confrontato con le concentrazioni riportate sulla scheda risultati presente nel kit e trascritto nell'apposito modulo.
Durante l'allestimento degli antimicogrammi sono stati riscontrati alcuni problemi tecnici in quanto il metodo Sensititre, validato solo per lieviti e aspergilli, come riportato dalla scheda tecnica del kit, non è risultato altrettanto efficace nei confronti dei dermatofiti. Infatti, in questo ultimo caso, molto spesso la lettura della piastra, anche dopo 72h di incubazione, non ha consentito di effettuare un'interpretazione efficace per tutte le molecole testate. Tale fenomeno potrebbe essere imputabile alla presenza di strutture ifali, tipiche dei funghi filamentosi in questione, e pertanto si è pensato di filtrare con appositi filtri da laboratorio (100µm FALCON®) la sospensione fungina prima dell'inoculo della piastra, onde poter trasferire solamente le spore. A seguito di tale variazione nella metodica, gli antimicogrammi, eseguiti su muffe dermatofitiche e non, hanno mostrato risultati più attendibili.
I ceppi fungini che hanno evidenziato resistenza nei confronti di una o più molecole, sono stati successivamente testati mediante metodica prevista dalle linee guida EUCAST, andando a valutare la sensibilità nei confronti di: Itraconazolo (Sigma-Aldrich, St. Louis USA) (0,03-16 mg/L), Voriconazolo (Sigma-Aldrich) (0,03-16 mg/L), Posaconazolo (Sigma-Aldrich) (0,03-16 mg/L), Isavuconazolo (Basilea Pharmaceutica, Switzerland) (0,03-16 mg/L), Amfotericina B (0,03-16 mg/L) (Sigma-Aldrich), 5- fluorocitosina (Sigma-Aldrich) (0,12-64 mg/L), Fluconazolo (Sigma-Aldrich) (0,12-64 mg/L). La lettura della minima concentrazione inibente (mg/l) è stata eseguita visivamente. In accordo con i breakpoints (BP) proposti da EUCAST, sono stati considerati resistenti gli isolati di A. fumigatus con MIC ≥ 4 mg/l per Itraconazolo, Voriconazolo o Amfotericina B, con MIC ≥ 0.5 mg/l per Posaconazolo o con MIC ≥ 2 mg/l per Isavuconazolo. Per gli altri antifungini non esistono BP. Per A. flavus non esistono BP di EUCAST, ma gli Epidemiological cut-off (ECOFF) corrispondono generalmente ad una diluizione superiore rispetto alla MIC di A. fumigatus. Per i miceti di più raro isolamento non esistono al momento BP disponibili.
Per quanto riguarda l'antimicogramma con metodo Vitek II, le molecole testate sono state Amfotericina B, 5-fluorocitosina, Fluconazolo, Voriconazolo, Caspofungina e Micafungina.
Su isolati di Aspergillus fumigatus che hanno mostrato all'antimicogramma quadri di multiresistenza o comportamenti anomali rispetto a quanto riportato in letteratura, sono state eseguite analisi molecolari per determinare eventuali meccanismi di resistenza presenti alla base, andando ad analizzare specifiche sequenze geniche a carico delle quali è stata valutata l'eventuale presenza di mutazioni responsabili del fenomeno. Si è deciso di escludere lieviti e dermatofiti da questa procedura perché resistenze più significative sono state riscontrate nelle muffe e perché sono la tipologia fungina attualmente meno studiata, soprattutto nell'ambito della medicina veterinaria.
Gli isolati sono stati sottoposti a PCR per il gene promotore e il gene cyp51A, le cui mutazioni sono responsabili del fenomeno resistenza; i primers utilizzati per amplificazione e sequenziamento sono riassunti in Tabella 2 (Primers utilizzati per amplificazione e PCR dei geni responsabili di resistenza).
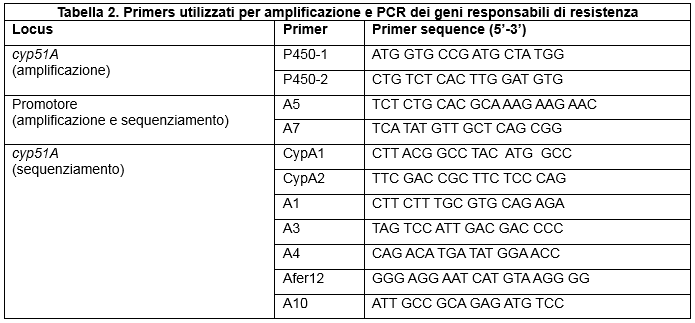
Table 2. Primers used for amplification and PCR of the genes responsible for resistance
La PCR di cyp51A e promotore è stata eseguita in un volume di reazione totale di 50 µl, contenente 5 µl di tampone PCR, 4 µl di MgCl2, 1 µl di dNTP (1,25 mM), 1 µl di ciascun primer, 2,6 µl di DMSO, 0,5 µl di AmpliTaq, 30 µl di H2O e 5 µl di DNA genomico. I prodotti amplificati sono stati purificati utilizzando Illustra Exoprostar1-step (Ge Healthcare Life Science, Regno Unito) e sono stati sequenziati con il kit di sequenziamento del ciclo Big-Dye Terminator (Applied Biosystems) seguendo le istruzioni del produttore, utilizzando i primers riportati in Tabella 2. Il DNA purificato (7 µl) è stato aggiunto in 7 µl di mix (0,6 µl di primer e 6,4 µl di acqua).
Infine, tre ceppi di Aspergillus fumigatus sono stati oggetto di genotipizzazione molecolare mediante tecnica TRESP, in modo da evidenziare i profili prevalenti nel nostro territorio. La tipizzazione TRESP è stata scelta in quanto è stato dimostrato avere buona riproducibilità, buona stabilità e buon potere discriminatorio. Sono state quindi analizzate specifiche sequenze geniche e confrontate con quelle esistenti nelle banche dati ufficiali.
I geni ricercati mediante la tipizzazione TRESP sono quelli che codificano per le seguenti proteine:
- proteina galattomannica antigenica (MP2)
- proteina ipotetica con dominio CFEM (CFEM)
- proteina di superficie A (CSP).
I tre bersagli sono situati in tre diversi cromosomi e sono conservati tra i funghi filamentosi, non mostrando alcuna omologia significativa a nessun gene dei lieviti: ciò potrebbe essere correlato alla loro distanza evolutiva. Successivamente, la genotipizzazione molecolare è stata confermata dal rilevamento del target del gene Erg4B.
I primers utilizzati per amplificare e sequenziare una sequenza parziale dei tre diversi geni sono elencati nella Tabella 3 (Primers utilizzati per la genotipizzazione molecolare TRESP).
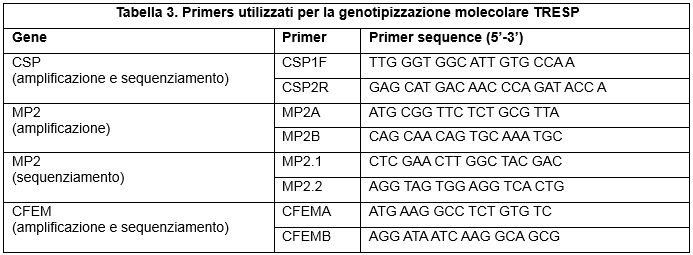
Table 3. Primers used for TRESP molecular genotyping
La PCR delle regioni CSP, MP2 e CFEM è stato eseguita in un volume totale di 50 µl contenente 5 µl di tampone PCR, 4 µl di MgCl2, 1 µl dNTP (1,25 mM), 1 µl di ciascun primer (CSP1F / CSP2R per CSP, MP2A / MP2B per MP2 e CFEMA / CFEMB per CFEM), 2,6 µl di DMSO, 0,5 µl di AmpliTaq, 30 µl di H2O e 5 µl di DNA genomico.
I prodotti amplificati sono stati purificati utilizzando Illustra Exoprostar1-step (Ge Healthcare Life Science, Regno Unito) e sequenziati con il kit di sequenziamento Big-Dye Terminator (Applied Biosystems) seguendo le istruzioni del produttore utilizzando gli stessi primers di amplificazione PCR per CSP e CFEM, ma per il gene MP2 è stato utilizzato un set di primers diverso (MP2.1 e MP2.2).
Il DNA purificato (7 µl) è stato aggiunto in 7 µl di miscela (0,6 µl di primers e 6,4 µl di acqua).
Risultati
Durante il periodo della ricerca sono stati raccolti un totale di n.2188 ceppi fungini di cui: n.2114 lieviti, n.38 dermatofiti e n.36 muffe non dermatofiti che.
L'elevato numero di lieviti rispetto agli altri miceti è determinato dagli isolati di derivazione umana; ciò deriva dal fatto che la casistica ospedaliera, soprattutto nel campo della diagnostica micologica applicata alla patologia respiratoria è molto cospicua rispetto a quella nei confronti di altre affezioni fungine.
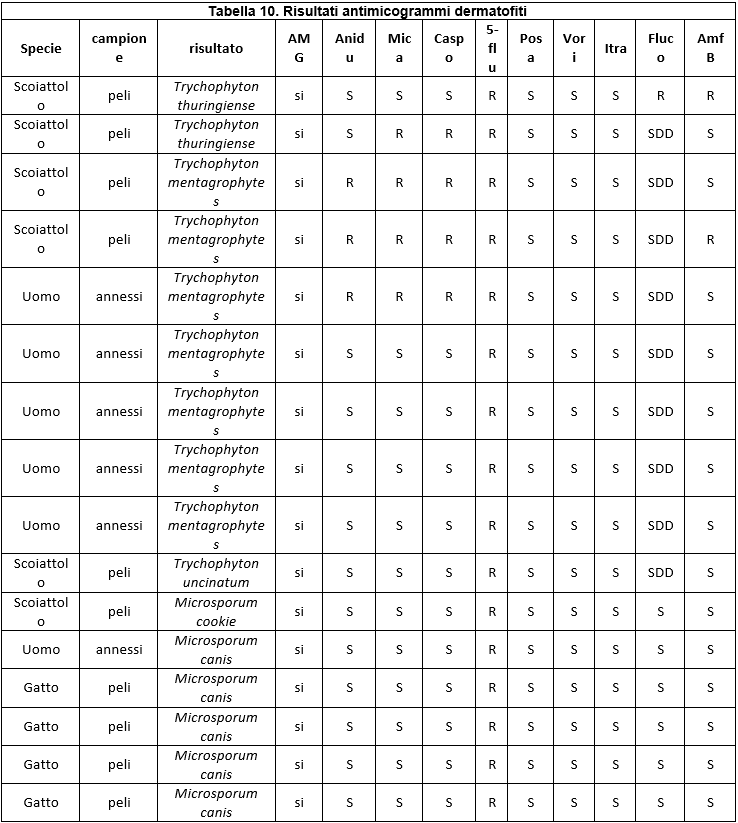
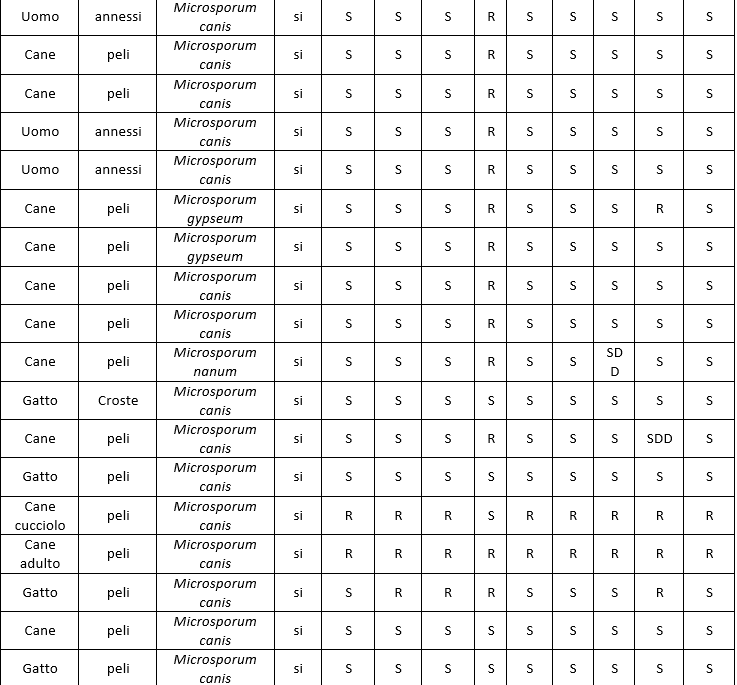
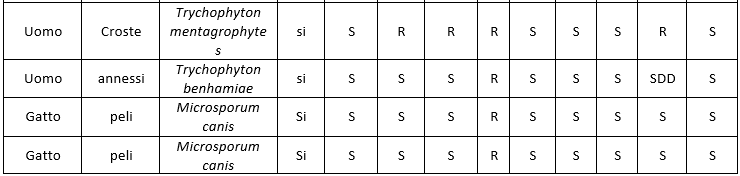
In particolare, le patologie micotiche della cute e degli annessi in umana vengono diagnosticate prevalentemente con esame clinico e, in presenza di animali in casa con sospetti problemi cutanei di natura micotica, non sempre i proprietari sono disponibili a sottoporsi a visita dermatologica. In Tabella 4 (Numero ceppi fungini isolati durante il periodo della ricerca) viene illustrata la provenienza dei vari ceppi raccolti.
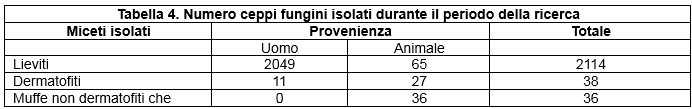
Table 4. Number of fungal strains isolated during the research
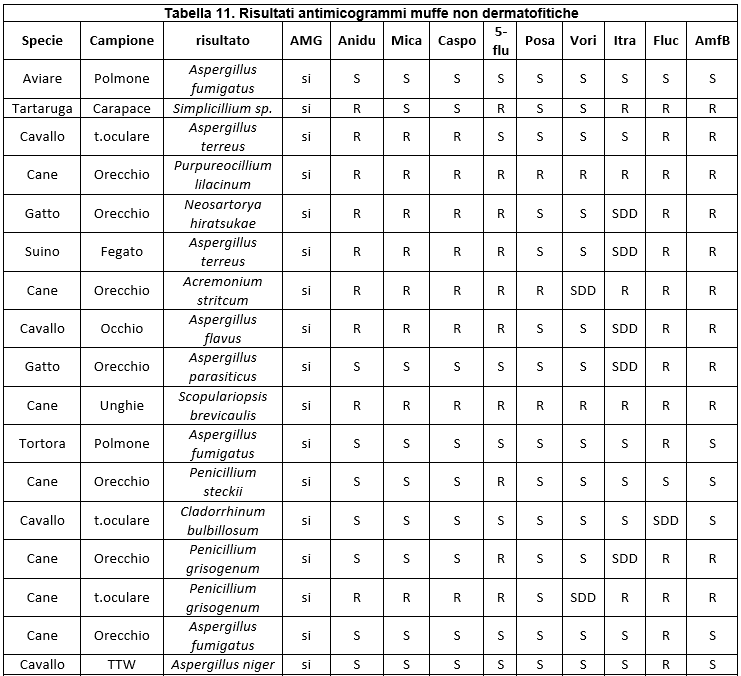
Nell'ambito delle varie tipologie fungine, le specie isolate sono risultate diverse, mettendo quindi in evidenza una diversa prevalenza nel territorio considerato (Tabella 5. Specie di lieviti isolate; Tabella 6.; Specie di dermatofiti isolate; Tabella 7. Specie di muffe non dermatofitiche).
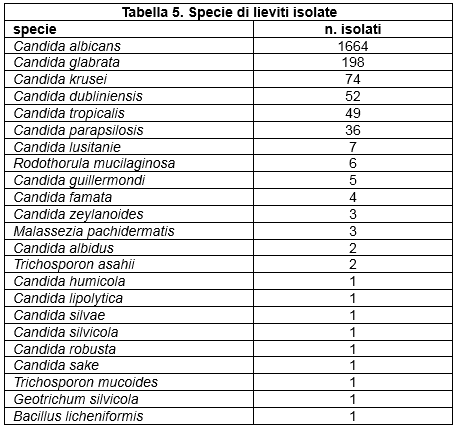
Table 5. Species of isolated yeasts

Table 6. Species of isolated dermatophytes
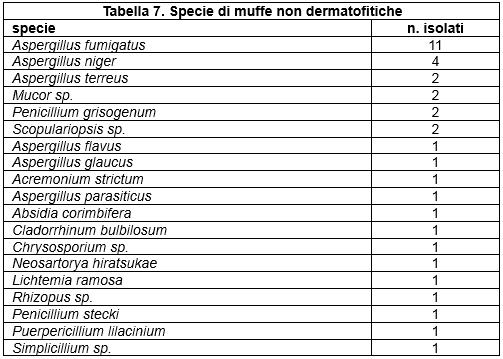
Table 7. Species of non-dermatophyte molds
Il confronto su base statistica ha fornito una buona concordanza tra le metodiche per quanto concerne l'identificazione dei lieviti; una concordanza sufficiente si è invece riscontrata nel caso delle muffe non dermatofitiche, mentre scarsa concordanza si è evidenziata nel caso dei dermatofiti, soprattutto fra metodo morfologico vs MALDI-TOF MS e metodo molecolare vs MALDI-TOF MS.
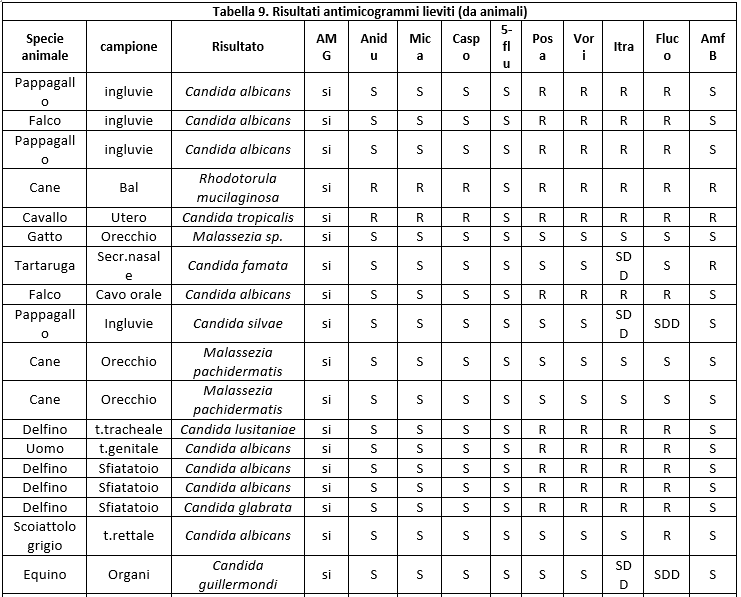
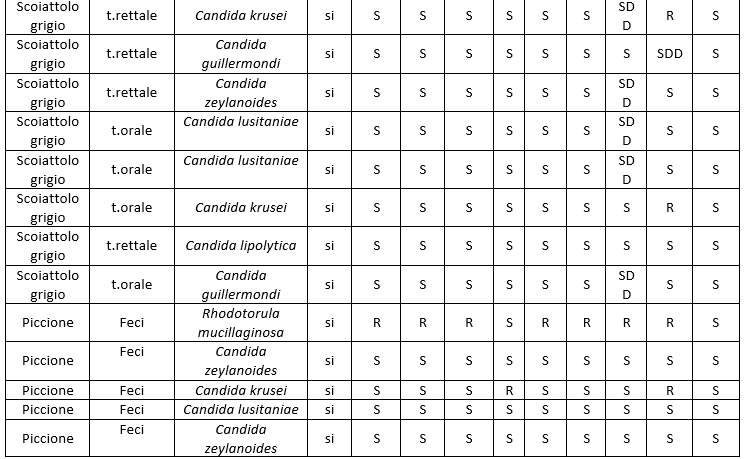
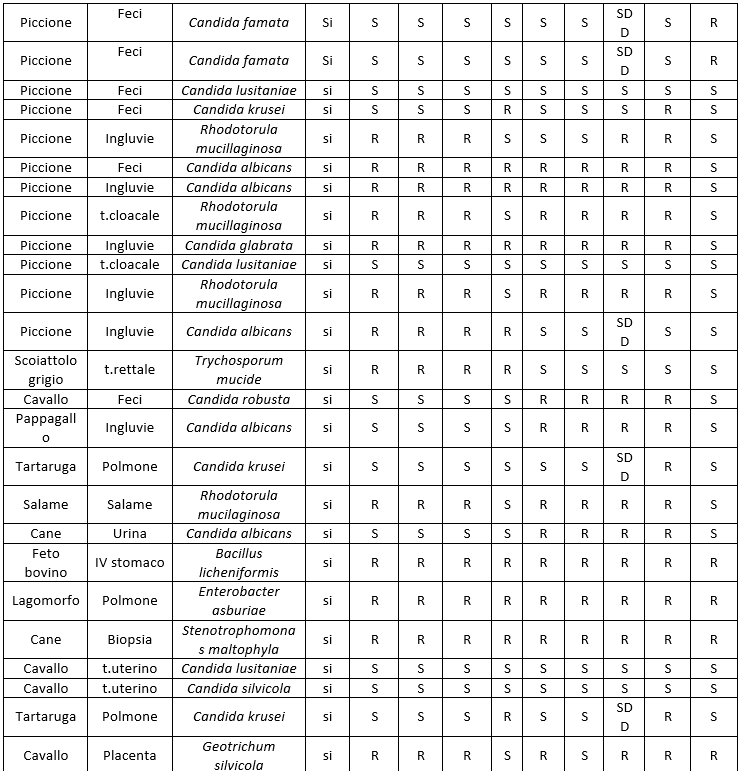
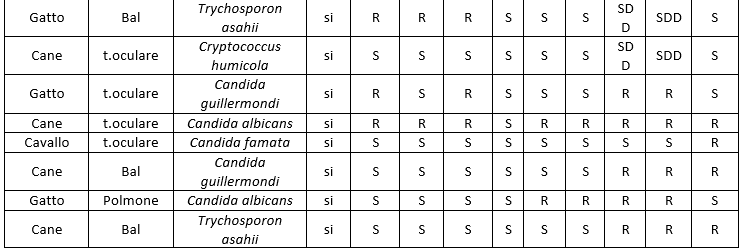
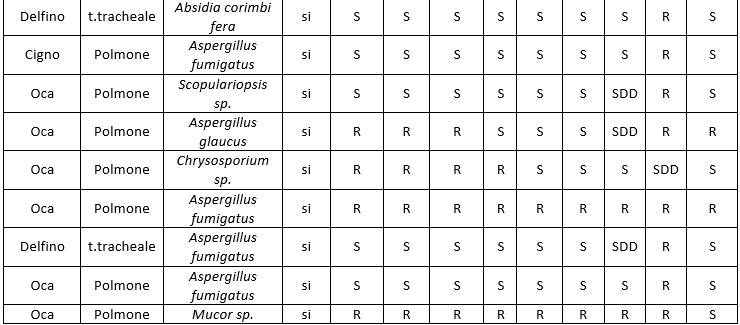
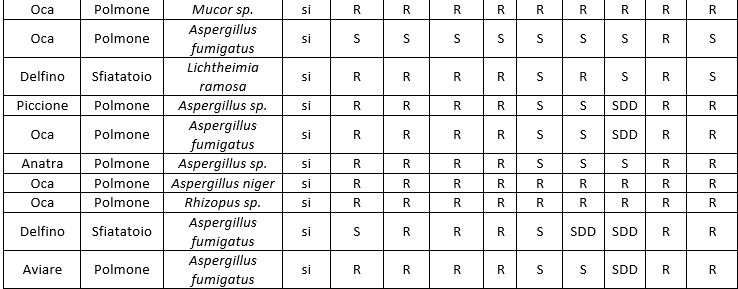
I dati relativi all'antimicotico resistenza, ottenuti con il metodo semiautomatico di microdiluizione in brodo con il kit SensititreY010, sono illustrati nelle tabelle: 8 (Risultati antimicogrammi lieviti da uomo), 9 (Risultati antimicogrammi lieviti - da animali), 10 (Risultati antimicogrammi muffe non dermatofitiche), 11 (Risultati antimicogrammi muffe non dermatofitiche).
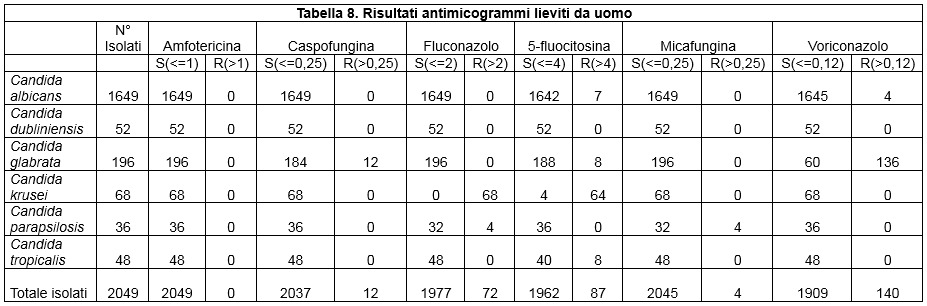
Table 8. Results yeast susceptibility test (from men)
Andando ad osservare il grado di resistenza nei ceppi fungini maggiormente isolati, quindi più rappresentativi, emerge quanto mostrato in Figure 1, 2, 3 e 4.
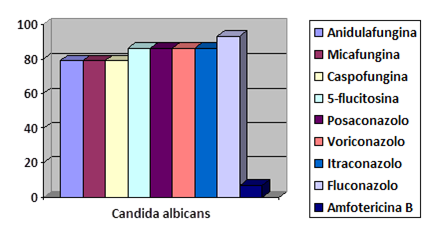
Figura 1. Percentuale resistenze in
Candida albicans
Figure 1. Percentage resistance in
Candida albicans
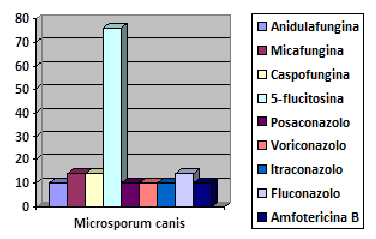
Figura 2. Percentuale resistenze in
Microsporum canis
Figure 2. Percentage resistance in
Microsporum canis
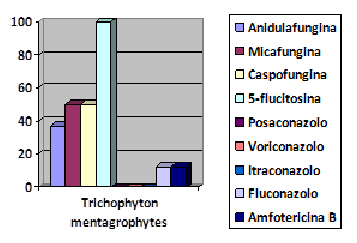
Figura 3. Percentuale resistenze in
Trichophyton mentagrophytes
Figure 3. Percentage resistance in
Trichophyton mentagrophytes
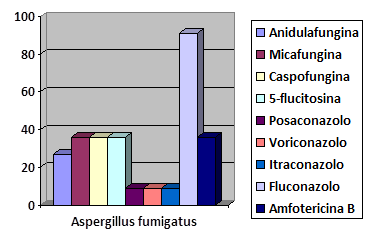
Figura 4. Percentuale resistenze in
Aspergillus fumigatus
Figure 4. Percentage resistance in
Aspergillus fumigatus
Su n.100 ceppi (n. 71 lieviti, n. 21 muffe non dermatofitiche e n. 8 dermatofiti) è stato eseguito, il test di suscettibilità agli antimicotici mediante microdiluizione in brodo secondo linee guida EUCAST, il quale ha fornito risultati sovrapponibili rispetto a quelli ottenuti mediante kit Sensititre Y010.
Dall'analisi molecolare dei fattori di resistenza, è emerso che nessuno dei ceppi testati presentava mutazioni a livello del gene cyp51A o mutazioni tandem a carico del promotore.
Relativamente alla genotipizzazione l'analisi su gel di agarosio del prodotto di PCR amplificato da primers CSP1F e CSP2R (per il gene CSP), MP2A e MP2B (per il gene MP2), CFEMA e CFEMB (per il gene CFEM) ha rivelato la presenza di una banda rispettivamente di circa 1156-1276 bp, 1128-1779 bp e 918-1044 bp. Successivamente, è stata eseguita la PCR per il gene Erg4B.
Tutti i prodotti di PCR purificati sono stati sequenziati mediante l'uso dei primers gene-specifici precedentemente descritti. Gli allineamenti delle sequenze finali nella banca dati hanno rivelato che tutti i ceppi sono differenti tipi molecolari, dato confermato dalla sequenza Erg4B e che sono "ceppi nuovi" rispetto alla banca dati esistente.
Durante la durata del progetto non sono state rilevate segnalazioni di reazioni avverse a seguito di trattamenti antimicotici né risposte di mancata efficacia delle molecole antifungine utilizzate.
Discussione e conclusioni
Le patologie micotiche, sebbene compaiano più frequentemente in soggetti con infezioni batteriche e virali già in atto, o comunque con sistema immunitario compromesso, in alcuni casi possono manifestarsi come malattie primarie e determinare anche quadri particolarmente seri. Infatti, in medicina umana è noto che l'incidenza della malattia fungina, responsabile di infezioni fatali, risulta in aumento nei paesi sviluppati a causa dell'incremento della popolazione a rischio (soggetti immunocompromessi). Negli ultimi anni, un analogo trend si sta osservando anche nella medicina veterinaria.
Da un punto di vista identificativo i nostri dati sono del tutto sovrapponibili con quanto già riscontrato in altre indagini, dove Candida albicans, Microsporum canis, Trichophyton mentagrophytes ed Aspergillus fumigatus sono i miceti più frequentemente isolati sia in ambito umano che veterinario.
Nel presente progetto di ricerca l'identificazione si è basata sull'utilizzo di varie metodiche di laboratorio; ai fini della valutazione della sensibilità/specificità dei metodi, sarebbe comunque opportuno, soprattutto per quanto concerne i dermatofiti e le muffe non dermatofitiche, incrementare il numero degli isolati. Possiamo comunque affermare che, in base alla nostra casistica, la metodica molecolare, costituita da PCR e sequenziamento, resta quella più sensibile e specifica di cui si dispone attualmente.
La scarsa concordanza riscontrata tra le varie tecniche diagnostiche, nei dermatofiti e nelle muffe non dermatofitiche, potrebbe essere causata dal fatto che la capacità di MALDI-TOF MS di identificare correttamente una grande varietà di ceppi e di discriminare tra quelli strettamente correlati, è direttamente dipendente dalla ampiezza del database di riferimento utilizzato per il confronto (ad oggi quello comprendente i ceppi fungini di origine animale è sicuramente inferiore rispetto a quello comprendente quelli di origine umana).
Nonostante ciò, però, un vantaggio di molte piattaforme di identificazione MALDI-TOF MS è quello di poter integrare i database di riferimento, attraverso un upload manuale, qualora si individuino delle specifiche carenze. Sarà pertanto interessante approfondire questo aspetto, incrementando le tipizzazioni di ceppi fungini di derivazione animale con tecnica MALDI, al fine di potenziare i database attualmente esistenti.
Nonostante le più moderne tecniche di identificazione abbiano permesso di superare i limiti presenti nelle metodiche di laboratorio di base (esame colturale), è ampiamente accertato che l'osservazione macroscopica e microscopica delle colonie fungine non debbano essere trascurate perché rappresentano un tassello fondamentale ai fini di una corretta identificazione.
In ambito terapeutico, le infezioni fungine possono costituire un ostacolo difficile da superare, sia in medicina umana che veterinaria, relativamente sia all'esiguità di molecole efficaci disponibili, sia alla possibilità che insorgano fenomeni di antimicoticoresistenza; da questo ultimo punto di vista, l'esecuzione dell'antimicogramma diventa quindi uno step fondamentale nel percorso diagnostico micologico.
A fronte di un aumento delle resistenze riscontrato negli ultimi anni, recentemente sembra che il tasso di questo aumento si sia fermato o addirittura invertito come risultato di trattamenti terapeutici innovativi o corrette strategie di gestione del rischio. Inoltre, grazie all'introduzione di appropriate misure di controllo, un contributo è stato dato anche dal limitato uso di queste sostanze (perlopiù azoli) in agricoltura, aspetto questo che sembrava strettamente correlato con il problema dell'antimicotico resistenza nei pazienti umani.
La suscettibilità agli antifungini non rappresenta però l'unico elemento che contribuisce alla resistenza clinica; altri aspetti come ad esempio la farmacocinetica dell'antifungino che viene utilizzato, fattori correlati all'ospite, il sito di infezione e fattori legati al patogeno stesso possono influenzare l'insorgenza del fenomeno.
Le valutazioni che sono state fatte nel presente progetto derivano perlopiù dai dati ottenuti con la tecnica della microdiluizione in brodo con kit commerciale SensititreY010 (per tutte le categorie fungine) e con Vitek II (per i lieviti); il metodo secondo EUCAST è stato impiegato solo su un ridotto numero di isolati fungini (quelli che hanno mostrato multiresistenze al SensititreY010 e al Vitek II) onde avere un confronto utile per una più corretta interpretazione dei dati.
Per quanto riguarda i lieviti, in accordo con quanto riportato in letteratura, anche i ceppi di Candida guillermondi, C. lusitaniae, C. parapsilosis e C. dubliniensis da noi isolati hanno mostrato una buona suscettibilità nei confronti degli azoli; invece, tutti i ceppi di Candida krusei sono risultati resistenti al Fluconazolo.
Da un punto di vista generale, le varie specie di Candida, hanno mostrato tassi di resistenza mediamente in linea rispetto a quelli riportati da altri autori; infatti, a fronte di valori di resistenza nei confronti del Fluconazolo di < 2,5%, i nostri isolati (umani più animali) hanno mostrato resistenza pari all'5%. Se però si considerano separatamente gli isolati di origine umana da quelli di origine animale, i valori di resistenza nei confronti del Fluconazolo sono stati di 3,5% e 50% rispettivamente. Questo ultimo dato va sicuramente approfondito, in quanto si discosta dal trend osservato in medicina umana; si potrebbe ipotizzare che sia dovuto a variazioni geografiche nella distribuzione delle specie di Candida e di conseguenza a variazioni nella prevalenza di resistenza e/o a fenomeni intrinseci all'ospite e/o al lievito (come riportato da altri autori).
Sempre nell'ambito dei lieviti, la resistenza nei confronti dell'Amfotericina B è stata dello 0,5%, quasi totalmente nei ceppi di origine animale: tale dato è sovrapponibile a quanto già descritto in letteratura, ossia che in generale le specie di Candida si dimostrano suscettibili a questa molecola. Al contrario, risultati discordanti con la letteratura, sono stati osservati nei riguardi della 5-fluorocitosina; infatti, se è notoriamente descritta una resistenza intrinseca di Candida verso tale molecola, i nostri isolati hanno mostrato bassi livelli di resistenza (4,6%), con comportamento omogeneo sia in quelli di origine umana che in quelli di origine animale.
Relativamente alle muffe non dermatofitiche ed in particolare al genere Aspergillus, si evince una quasi totalità di resistenza nei confronti del Fluconazolo, non accompagnata però da simile comportamento per altri composti azolici, come ad esempio Itraconazolo, verso cui si è rilevata una resistenza pari al 10%. Condizione piuttosto variabile è quella che si riscontra in Aspergillus nei confronti dell'Amfotericina B; nello specifico, negli isolati considerati, è stato possibile constatare valori di resistenza che si avvicinano al 58%. Anche altri autori sostengono che la variabilità possa essere legata a diversi fattori, quali ad esempio la specie considerata.
Un aspetto importante che deve essere sottolineato è l'assenza, nelle muffe non dermatofitiche, di un metodo validato per i test di suscettibilità in vitro che potrebbe ostacolare il rilevamento della resistenza ai farmaci antimicotici; pertanto il reale tasso di resistenza antifungina è sconosciuto.
Anche alla luce di questa problematica, negli isolati di Aspergillus fumigatus che hanno mostrato un comportamento interessante alle metodiche fenotipiche di valutazione della suscettibilità antifungina, si è deciso di procedere con una valutazione di conferma attraverso la biologia molecolare. E' noto che isolati clinici di A. fumigatus resistenti agli azoli possono mostrare diverse mutazioni responsabili dell'aumento delle MIC a uno, due o tutti i triazoli; inoltre i ceppi clinici che presentano tali mutazioni mostrano resistenza verso Itraconazolo e producono MIC elevate nei confronti di Posaconazolo ma non di Voriconazolo.
La mutazione a livello di metionina 220 (M220) invece, produce resistenza all'Itraconazolo e una ridotta sensibilità a Posaconazolo, Voriconazolo e Ravuconazolo. Una sostituzione in posizione G138C è stata riportata anche nei ceppi clinici di pazienti sottoposti a trattamento con azoli. Nel nostro progetto nessuno dei ceppi di A. fumigatus testati ha mostrato le mutazioni descritte: probabilmente le resistenze fenotipiche riscontrate sono correlate a resistenze intrinseche del micete stesso nei confronti della specifica molecola testata (es. A. fumigatus vs Fluconazolo); tuttavia, da questo punto di vista, non è neanche possibile escludere che i metodi fenotipici siano meno specifici rispetto alle tecniche molecolari.
Per quanto riguarda infine i dermatofiti, il dato più significativo emerso nel corso della ricerca è la quasi totale resistenza degli isolati, sia di origine umana che animale, nei confronti della 5-fluorocitosina (87%); le uniche sensibilità riscontrate risultano a carico di n.4 isolati di Microsporum canis. Come evidenziato già in letteratura, non sono stati evidenziati quadri di multiresistenza da parte dei dermatofiti isolati durante la ricerca. La bassa numerosità dei campioni raccolti, imputabile al fatto che sia in medicina umana che veterinaria la diagnostica delle patologie fungine cutanee è prevalentemente basata sull'osservazione clinica, associata anche ai pochi dati disponibili in letteratura, rende necessario un approfondimento in tal senso.
Per quanto riguarda la segnalazione di eventuali reazioni avverse e/o di mancata efficacia terapeutica, è stata data precedenza esclusivamente a quelle riscontrate su animali; va tuttavia sottolineato il fatto che c'è stato un ridotto ritorno, pervenendo infatti soltanto n. 5 schede.
Globalmente, il reperimento di campioni di origine animale è stato piuttosto difficoltoso rispetto alla disponibilità dei campioni di origine umana; ciò si può ricondurre a diversi fattori, quali la maggiore sottostima delle patologie fungine in veterinaria rispetto al settore umano, la maggior tendenza da parte dei veterinari ad un approccio esclusivamente clinico-terapeutico, non sempre supportato dalla diagnostica di laboratorio e la scarsa collaborazione dei proprietari di animali alla gestione del caso clinico micologico (soprattutto per le affezioni cutanee che ovviamente non necessitano di ricovero dell'animale) soprattutto dal punto di vista terapeutico (spesso non si hanno notizie sul follow-up della micosi e/o si riscontrano irregolarità nel rispetto del protocollo terapeutico).
Bibliografia
Agnetti F., Sola D., Scoccia E., Moretta I., Maresca C., Moretti A. (2011). "Lieviti nella mucosa orofaringea e cloacale di rettili: considerazioni biologico-sanitarie". Summa Animali da Compagnia, 9: 23-29.
Agnetti F., Crotti S., Sgariglia E., Palmieri M., Stefanetti V., Filippini G., Pitzurra L., Passamonti F. (2013). "Isolation of Candida famata from an equine aborted fetus: a case report". Mycoses, 56(3):84-85.
Altman D.G. (1991). Practical Statistics for Medical Research. Chapman and Hall, London.
Buchan B.W., Ledeboer N.A. (2013). Advances in Identification of Clinical Yeast Isolates by Use of Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry. J. Clin. Microbiol., 51(5):1359-1365.
Cafarchia C., Gasser R.B., Figueredo L.A., Weigl S., Danesi P., Capelli G., Otranto D. (2013). An improved molecular diagnosis assay for canine and feline dermatophytosis. Medical Mycology, 51: 136-143.
Chryssanthou E. (1997). In vitro susceptibility of respiratory isolates of Aspergillus species to itraconazole and amphotericin B acquired resistance to itraconazole. Scand J Infect Dis, 29:509-512.
Dannaoui E., Persat F., Monier M.F., Borel E., Piens M.A., Picot S. (1999). In vitro susceptibility of Aspergillus spp. isolates to amphotericin B and itraconazole. J Antimicrob Chemoter, 44:553-555.
Dannaoui E., Borel E., Persat F., Piens M.A., Picot S. (2000). Amphotericin B resistance of Aspergillus terreus in a murine model of disseminated aspergillosis. J Med Microbiol, 49:601-606.
Dannaoui E., Borel E., Monier M.F., Piens M.A., Picot S., Persat F. (2001). Acquired itraconazole resistance in Aspergillus fumigatus. J Antimicrob Chemother, 47:333-340.
EUCAST DEFINITIVE DOCUMENT EDef 7.1: method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for yeasts. EUCAST E.DEF 7.3 December 2015.
EUCAST DEFINITIVE DOCUMENT E.DEF 9.1: method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for conidia forming moulds. EUCAST E.DEF 9.3 December 2015.
Fan W.T., Qin T.T., Bi R.R., Kang H.Q., Ma P., Gu B. (2017). Performance of the matrix-assisted laser desorption ionization time-of-flight mass spectrometry system for rapid identification of streptococci: a review. Eur J Clin Microbiol Infect Dis. Jun, 36(6):1005-1012.
Gomez-Lopez A., Mellado E., Rodriguez-Tudela J.L., Cuenca-Estrella M. (2005). Susceptibility profile of 29 clinical isolates of Rhodotorula spp. and literature review. Journal of Antimicrobial Chemotherapy, 55:312-316.
Larena I., Salazar O., Gonzalez V., Julia M.C., Rubio V. (1999). Design of primer for ribosomal DNA internal transcribed spacer with enhanced specificity for ascomycetes. Journal of Biotechnology, 75: 187-194.
Leaw S.N., Chang H.C., Sun H.F., Barton R., Bouchara J.P., Chang T.C. (2006). Identification of Medically Important Yeast Species by Sequence Analysis of the Internal Transcribed Spacer Regions. Clin Microbiol, 44(3): 693-699.
Marenzoni M.L., Morganti G., Moretta I., Crotti S., Agnetti F., Moretti A., Pitzurra L., Casagrande Proietti P., Sechi P., Cenci-Goga B., Franciosini M.P. (2016). Microbiological and parasitological survey of zoonotic agents in apparently healthy feral pigeons. Polish Journal of Veterinary Sicences, 19(2): 309-315.
Moretti S., Bozza S., D'Angelo C., Casagrande A., Della Fazia M.A., Pitzurra L., Romani L., Aversa F. (2012). Role of innate immune receptors in paradoxical caspofungin activity in vivo in preclinical aspergillosis. Antimicrob Agents Chemother, 56(8):4268-4276.
Moretti S., Bozza S., Massi-Benedetti C., Prezioso L., Rossetti E., Romani L., Aversa F., Pitzurra L. (2014). An immunomodulatory activity of micafungin in preclinical aspergillosis. J Antimicrob Chemother, 69(4):1065-1074.
Moretti A., Agnetti F., Mancianti F., Nardoni S., Righi C., Moretta I., Morganti G., Papini M. (2013). Dermatophytosis in animals: epidemiological, clinical and zoonotic aspects. G Ital Dermatol Venereol, 148:563-572.
Moretti A., Moretta I., Agnetti F., Morganti G., Leonardi L., Veronesi F. (2013). L'aborto ad eziologia micotica nella specie bovina. Large Animal Review, 19: 155-161.
Nadas G.C., Rapuntean G., Chirila F., Rapuntean S., Bolfa P., Bouari C. (2011). The sensibility to antimycotics of some Candida spp. Strains isolated from humans and animals. Bulletin UASVM, Veterinary Medicine, 68 (1): 268-271.
Perea S., Patterson T.F. (2002). Antifungal resistance in pathogenic fungi. Clinical Infectious Diseases, 35:1073-1080.
Pfaller M.A., Lockhart S.R., Pujol C., Swails-Wenger J.A., Messer S.A., Edmond M.B., Jones R.N., Wenzel R.P., Soll D.R. (1999). Hospital specificity, region specificity, and fluconazole resistance of Candida albicans bloodstream isolates. J Clin Microbiol, 37:870-872.
Pfaller M.A., Jones R.N., Doern G.V., Sader H.S., Messer S.A., Houston A., Coffman S., Hollis R.J. (2000). Bloodstream infections due to Candida species: SENTRY antimicrobial surveillance program in North America and Latin America, 1997-1998. Antimicrob Agents Cheother, 44:747-751.
Puccini S., Valdré A., Papini R., Mancianti F. (1992). In vitro susceptibility to antimycotics of Microsporum canis isolates from cats. , 201(9):1375-1377.
Saffert R.T., Cunningham S.A., Ihde S.M., Jobe K.E., Mandrekar J., Patel R. (2011). Comparison of Bruker biotyper matrix - assisted laser desorption ionization - time of flight mass spectrometer to BD Phoenix automated microbiology system for identification of Gram-negative bacilli. J. of Clin. Microbiol, 49(3): 887-892.
Stefanetti V., Marenzoni M.L., Lepri E., Coletti M., Sebastianelli M., Agnetti F., Vuerich M., Passamonti F. (2015). Five fatal cases of primary Aspergillosis in Albino Asinara donkey foals. Journal of Equine Veterinary Science, 35: 76-79.
Stefanetti V., Marenzoni M.L., Lepri E., Coletti M., Casagrande Proietti P., Agnetti F., Crotti S., Pitzurra L., Del Sero A., Passamonti F. (2014). A case of Candida guilliermondii abortion in an Arab mare. Medical Mycology Case Reports, 4: 19-22.
Winstanley T., Courvalin P. (2011). Expert systems in clinical microbiology. Clin Microbiol Rev, 24(3):515-556.

Sgariglia et al, 2018 - Valutazione dell'antimicoticoresistenza in miceti di interesse medico e veterinario isolati in Umbria: risultati ricerca corrente IZSUM 04/2014 (SPVet.it 106/2018)